微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 烧杯中盛有100mL1.0mol/L的NaHSO4溶液,向其中逐滴滴加1.0 mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法正确的是?(????)
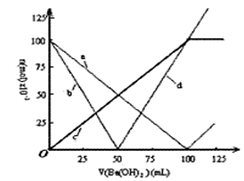
A.曲线a表示H+的物质的量的变化
B.直线d表示OH-的物质的量的变化
C.曲线c表示Ba2+的物质的量的变化
D.加入Ba(OH)2溶液50mL反应的离子方程式为:
Ba2+ +OH—+H++SO42-=BaSO4↓+H2O
参考答案:B
本题解析:本题主要是考查离子反应过程中各离子的数量关系;涉及的反应有:
OH—+H+=H2O??? Ba2+ +SO42-=BaSO4↓
随着溶液的滴加,溶液中各离子的物质的量为:
?
H+
SO2-4
Ba2+
SO42-
0 ml
0.1
0.1
0
0
50 ml
0
0.05
0
0
100 ml
0
0
0
0.1
由上表可知,加入Ba(OH)2溶液50mL时,Ba(
本题难度:简单
2、选择题 工业废气中氮的氧化物是重要的污染源,有一种治理污染的方法是通入适量氨气将其还原为无毒物质N2和H2O,现有含氮氧化物NO和NO2的混合气体3L,用相同条件下的NH3?3L恰好反应完全,则混合气中NO与NO2的体积分数比
A.l:4
B.1:3
C.l:2
D.l:l
参考答案:D
本题解析:
试题分析:氮氧化物与氨气发生的反应是氧化还原反应,氮氧化物把氨气氧化为氮气,本身被还原为氮气,可以根据氧化还原反应的电子守恒计算;氨气被氧化为氮气,NH3~1/2N2~3e-;一氧化氮被还原为氮气,NO~1/2N2~2e-二氧化氮被还原为氮气NO2~1/2N2~4e-,设一氧化氮体积为x,二氧化氮体积为3-x,氨气的体积为3L,根据电子守恒可知:3L×3=2x+4(3-x),x=1.5L,二氧化氮体积为1.5L,则相同条件下,混合气体中NO和NO2的体积比等于物质的量之比为1:1;选D。
本题难度:一般
3、选择题 下列说法正确的是
A.1mol任何物质都会有约6.02×1023个分子
B.物质的量既是物质的数量又是物质的质量
C.40gNaOH溶于1L水中,所得溶液浓度为1mol/L
D.气体的摩尔体积不一定是22.4L/mol
参考答案:D
本题解析:
试题分析:A、1mol任何物质中都含有约6.02×1023个微粒,构成物质的微粒不一定是分子,错误;B、物质的量只表示一定数目的粒子的集合体,不表示物质的数量或物质的质量,错误;C、40gNaOH的物质的量是mol,但溶于L水中得到的溶液的体积不是L,所以所得溶液浓度不为1mol/L,错误;D、气体的摩尔体积不一定是22.4L/mol,标准状况下气体的摩尔体积是22.4L/mol,与温度、压强有关系,正确,答案选D。
考点:考查对物质的量、物质的量浓度、气体摩尔体积的判断
本题难度:一般
4、选择题 下列说法正确的是(设阿伏加德罗常数的数值为6.02×1023)(??? )。
A.在标准状况下,22.4 L苯所含分子数目为6.02×1023
B.1 mol/L K2SO4溶液所含K+数目为2×6.02×1023
C.在常温常压下,16 g 02和03的混合气体所含原子数目为6.02×1023
D.2.4 g Mg与足量盐酸完全反应时,失去电子数目为O.1x 6.02×1023
参考答案:C
本题解析:A:标准状况下苯为液体,不符合气体的摩尔体积,不正确
B:溶液没有体积,无法计算其中的微粒数目,不正确
C:混合气体均由氧元素组成,故16 g混合气体含有的氧原子一定为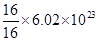 个,正确
个,正确
D:由Mg-2e-=Mg2+可知,2.4 g Mg与足量盐酸完全反应时,失去电子数目为 本题难度:一般
本题难度:一般
5、选择题 在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是
A.p(Ne)>p(H2)>p(O2)
B.p(O2)>p(Ne)>p(H2)
C.p(H2)>p(O2)>p(Ne)
D.p(H2)>p(Ne)>p(O2)
参考答案:D
本题解析:
试题分析:氖气、氢气和氧气的相对分子质量分别是20、2、32,根据PV=nRT可知在温度和密度都相同条件下,压强与摩尔质量成反比,所以其压强大小顺序是P(H2)>P(Ne)>P (O2),答案选D。
考点:考查阿伏伽德罗定量及其推论的有关应用
本题难度:一般