微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲中盛放
100mL 6mol/L的HCl溶液,烧杯乙中盛放100mL冷水。现向烧杯甲的溶液中放入25g NaOH固体,同时向烧杯乙中放入25g NH4NO3固体,搅拌使之溶解。
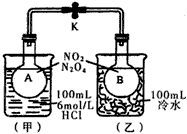
(1)A瓶中气体颜色______________,理由是__________________________。
(2)B瓶中气体颜色______________,理由是__________________________。
参考答案:(1)加深;酸碱中和反应放出热量,使平衡2NO2![]()
本题解析:
本题难度:一般
2、选择题 相同温度下,反应Br+H2→HBr+H可由过程Ⅰ或过程Ⅱ实现,其能量变化如图所示。
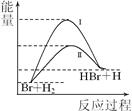
则下列叙述正确的是
A.该反应为放热反应
B.反应热:过程I>过程II
C.过程Ⅱ的平衡常数>过程I的平衡常数
D.形成1 mol 化学键释放的能量:H—Br<H—H
参考答案:D
本题解析:
试题分析:反应物的总能量小于生成物的总能量,为吸热反应,A错误;过程I和过程II的反应热相同,B错误; 过程Ⅱ是加入催化剂,温度不变,平衡不发生移动,故平衡常数不变,C错误;形成1 mol 化学键释放的能量:H—Br<H—H,D正确,答案选D.
考点:反应热、平衡常数
本题难度:一般
3、填空题 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)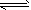 CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表
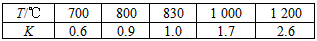
回答下列问题:
(1)该反应为________反应(填“吸热”“放热”)。
(3)能判断该反应是否已达化学平衡状态的依据是________。
a.容器中压强不变 b.混合气体中c(CO)不变 c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,在2 L的密闭容器中,加入1 mol CO2和1 mol H2充分反应达平衡时,CO平衡浓度为
0.25 mol/L,试判断此时的温度为________℃。
(4)若在(3)所处的温度下,在1 L的密闭容器中,加入2 mol CO2和3 mol H2充分反应达平衡时,H2的物质的量为________。
a.等于1.0 mol b.大于1.0 mol c.大于0.5 mol d.无法确定
参考答案:(1)吸热
(2)bc
(3)830
(
本题解析:
本题难度:一般
4、填空题 某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表
B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表
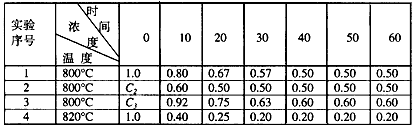
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为_________mol/(L·min)。
(2)在实验2,A的初始浓度C2=_________mol/L。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3_________V1(填>、=、<=,且C3
_________1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是_________反应(选填吸热、放热)。理由是___________________________
参考答案:(1)0.013
(2)1.0
(3)>;>
本题解析:
本题难度:一般
5、填空题 (5分)在固定容积的密闭容器中,有可逆反应nA(g)+mB(g)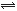 pC(g)处于平衡状态(已知n+m>p,△H>0)。升高温度时c(B)/c(C)的比值 ,混合气体的密度 ;降温时,混合气体的平均相对分子质量 ;加入催化剂,气体的总物质的量 ;充入C,则A、B的物质的量 。(填增大、减小、不变、不确定)
pC(g)处于平衡状态(已知n+m>p,△H>0)。升高温度时c(B)/c(C)的比值 ,混合气体的密度 ;降温时,混合气体的平均相对分子质量 ;加入催化剂,气体的总物质的量 ;充入C,则A、B的物质的量 。(填增大、减小、不变、不确定)
参考答案:减小;不变;减小;不变;增大
本题解析:
试题分析:由于该反应的正反应是吸热反应,所以根据平衡移动原理:升高温度,平衡向正反应方向移动,c(B)减小,c(C)增大,所以c(B)/c(C)减小;因为反应前后气体的质量不变,容器的容积也不变,所以混合气体的密度不变;降温时,平衡向放热反应方向移动,即向逆反应方向移动,由于该反应的正反应是气体体积减小的反应,所以平衡逆向移动,气体的物质的量增大,而气体的质量不变,所以混合气体的平均相对分子质量减小;加入催化剂,平衡不发生移动,气体的总物质的量不变;充入C,会发生反应产生A、B两种物质,则A、B的物质的量增大;
考点:考查外界条件对混合气体的密度、平均相对分子质量、物质的量等的影响的知识。
本题难度:一般