微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)除去蒸馏水中溶解的O2常采用___________ 的方法。
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出
NaOH溶液。这样操作的理由是_______________
方法二:在下图所示装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
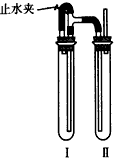
(3)在试管I里加入的试剂是________。
(4)在试管Ⅱ里加入的试剂是___________。
(5)为了制得白色Fe(OH)2沉淀,在试管I和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是_________________
(6)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是________________。
2、实验题 “酒是陈的香”的原因之一是储存过程中生成了有香味的酯。实验室用下图所示装置制取乙酸乙酯。
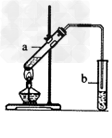
(1)试管a中生成乙酸乙酯的化学反应方程式是???????????????????? 。
(2)试管b中盛放的试剂是????????????????? 溶液,试管b中的导管不伸入液面下的原因是????????????????? 。试管b中发生反应的化学方程式是???????????????????? 。
(3)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有( 填序号)????????????????????? 。
①单位时间里,生成1mol 乙酸乙酯,同时生成1mol 水
②单位时间里,生成1mol 乙酸乙酯,同时生成1mol 乙酸
③单位时间里,消耗1mol 乙醇,同时消耗1mol 乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
3、填空题 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺:
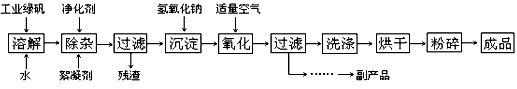
已知:① 工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
请回答下列问题:
(1)铁的常见氧化物有_________________ ;
(2)Fe3O4与稀硝酸反应的离子方程式是___________ ,检验反应后的溶液中含Fe3+的方法_______ ;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是:____________________ ;
(4)生产中可获得的副产品是__________,提取该副产品的操作顺序是_________ (填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为_______________ m3/h(假设反应在标准状态下进行,空气中O2占20%)。
4、简答题 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式______;
(2)浓硫酸的作用是:①______;②______;
(3)饱和碳酸钠溶液的主要作用是______;
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止______.
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是______.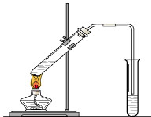
5、实验题 利用下图进行有关铁与水反应的实验,并利用产物进一步制取FeCl3·6H2O晶体(图中夹持及尾气处理装置均已略去)

(1)装置B中发生反应的化学方程式是______________________;
(2)装置E中的现象是______________;
(3)若将B中的固体溶于盐酸,检验所得溶液中Fe3+的最佳试剂是______________;
(4)若用上述溶液制取FeCl3·6H2O晶体,流程如下
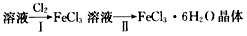
①步骤I中通入Cl2的作用是____________;
②从FeCl3溶液中结晶出FeCl3·6H2O晶体,要始终保持溶液呈较强的酸性,请说明原因:_____________。