微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 苯甲酸广泛应用于制药和化工行业。某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理

实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
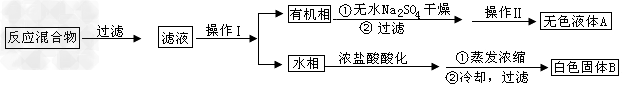
已知:苯甲酸分子量是122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为________,操作Ⅱ为________。
(2)无色液体A是,定性检验A的试剂是________,现象是________________________。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔。该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在答题卡上完成表中内容。
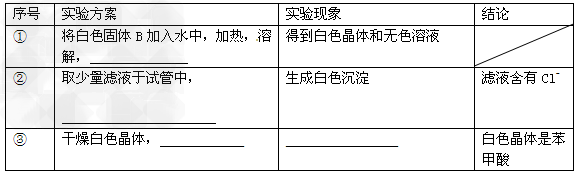
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10-3mol。产品中甲苯酸质量分数的计算表达式为_________,计算结果为________(保留两位有效数字)。
2、实验题 按照下面的实验步骤可以制备氢氧化铁胶体:
①用烧杯取少量蒸馏水,用酒精灯加热至沸腾;②向沸水中逐滴加入少量饱和FeCl3溶液。
(1)观察FeCl3溶液和Fe(OH)3胶体,两者具有的共同性质是____________(填字母)
A.都呈红褐色 B.都较稳定 C.都是透明的液体
(2)如何检验你是否制得了胶体?_____________________________。
(3)已知Fe(OH)3胶体粒子带有电荷,由于电解质电离生成的阳离子或阴离子能中和胶体粒子所带的电荷,从而使胶体发生聚沉作用而生成沉淀。请你预测向Fe(OH)3胶体中逐滴滴加稀H2SO4可能出现的现象是_____________________________。
3、实验题 用下面所示的A、B、C三种装置都可制取溴苯,请仔细分析三套装置的特点,然后回答下列问题

(1)装置A、C中长导管的作用是___________________。
(2)C装置已连接好,并进行了气密性检验,也装入了合适的药品,接下来要使反应开始,对C应进行的操 作是:_________________。
(3)A中存在加装药品和不能及时密封的矛盾,因而在实验中易造成的不良后果是:_______________。
(4)B中采用了双球吸收管,其作用是_______________________;反应后双球吸收管中可能出现的现象是
__________________;双球吸收管内液体不能太多,原因是_____________________。
(5)B装置存在两个明显的缺点,使实验的效果不好或不能正常进行,这两个缺点是:____________________________。
(6)分析上面三套实验装置后,某研究性学习小组又设计了如下图制备溴苯的第四套装置D,请分析其优点:

①有分液漏斗,可以通过控制液溴的量控制反应的量;
②____________________________;
③烧瓶上方的导气管较长,可以使反应液冷凝回流;
④____________________________。
4、实验题 实验室中以铝土矿(主要成分是Al2O3和少量的SiO2和Fe2O3杂质)为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如下:
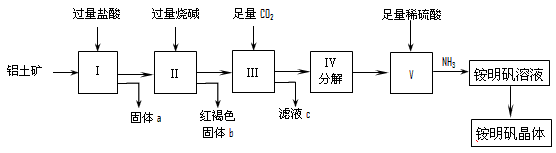
试回答下列问题:
⑴固体a的化学式为_____,III中通入过量CO2气体的离子方程式为____________ 。
⑵由V制取铵明矾溶液的化学方程式为_________________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________ 、冷却结晶、过滤洗涤。
⑶以1000kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84g/cm3)___________L(保留一位小数)。
⑷若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中Al2O3和H2SO4的物质的量之比为___________。
5、简答题 溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
NaBr+H2SO4→NaHSO4+HBr
CH3CH2OH+HBr
硫酸
CH3CH2Br+H2O
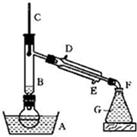
某课外小组欲在实验室制备溴乙烷的装置如图.数据如表.
物质
数据 | 乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸
密度/g?cm-3
0.79
1.46
2.2
0.71
1.84
熔点(℃)
-130
-119
9
-116
10
沸点(℃)
78.5
38.4
132
34.6
338
在水中的溶解度(g/100g水)
互溶
0.914
1
7.5
互溶
请回答下列问题.
(1)加入药品之前须做的操作是:______,实验进行的途中若发现未加入碎瓷片,其处理的方法是______.
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是______.温度计的温度应控制在______之间.
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是______,______,此操作可在______(填写玻璃仪器名称)中进行,同时进行分离.
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了______.
(5)粗产品中含有的主要有机液体杂质是______,为进一步制得纯净的溴乙烷,对粗产品进行水洗涤、分液,再加入无水CaCl2,进行______操作.
|