微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 0.1mol·L¯1 的Na2S溶液中,下面说法正确的是
A.c(Na+) +c(H+)=c(OH-)+c(HS-)+c(S2-)
B.c(Na+) =2c(HS-) +2c(S2-) +c(H2S)
C.c(Na+)>c(OH-)>c(HS-)>c(H+)
D.c(H2S)+ c(HS-)+ c(H+)= c(OH-)
参考答案:C
本题解析:
试题分析:A是电荷守恒,应该为:c(Na+) +c(H+)=c(OH-)+c(HS-)+2c(S2-) ,A错,B是物料守恒,应该是 c(Na+) =c(HS-) +c(S2-) +c(H2S),B错;S2-发生水解S2- +H2O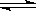 HS-+ OH-,水还会电离出OH-,故c(OH-)>c(HS-),C对;D是质子守恒,应该是2c(H2S)+ c(HS-)+ c(H+)= c(OH-),D错。选C
HS-+ OH-,水还会电离出OH-,故c(OH-)>c(HS-),C对;D是质子守恒,应该是2c(H2S)+ c(HS-)+ c(H+)= c(OH-),D错。选C
考点:盐类水解、离子浓度的大小比较。
本题难度:一般
2、选择题 下列叙述正确的是( )
A.强电解质溶液的导电能力一定比弱电解质溶液强
B.因为醋酸是弱电解质,盐酸是强电解质,因此中和等体积等物质的量浓度的醋酸和盐酸时,中和盐酸消耗的氢氧化钠比中和醋酸多
C.物质的量浓度相同的磷酸钠和磷酸溶液中PO43
参考答案:
本题解析:
本题难度:一般
3、选择题 为除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入的一种试剂是
A.NaOH
B.Na2CO3
C.氨水
D.MgO
参考答案:D
本题解析:
试题解析:A、加NaOH也会使Mg2+沉淀,错误;B、加Na2CO3不仅会使Mg2 +沉淀同时还引入了CO32-,错误;C、加氨水也会使Mg2+沉淀,错误;D、在加热搅拌下加MgO会促进Fe3+水解生成Fe(OH)3沉淀从而达到除杂的目的,正确,答案选D。
考点:考查离子的反应、水解、除杂等知识
本题难度:一般
4、填空题 (10分)
(1)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应正极电极反应式为_______;放电时,CO32-移向电池的______(填“正”或“负”)极。
(2)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(3)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是__________(用离子方程式和必要的文字说明)。
参考答案:(1) O2+4e-+2CO2=2CO32-;负;(2)4.
本题解析:
试题分析:(1)在该燃料电池中,正极上是O2得到电子与CO2结合形成CO32-,电极反应式是:O2+4e-+2CO2 =2CO32-电池放电时,根据同种电荷相互排斥,异种电荷相互吸引的原则,CO32-移向正电荷较多的电池的负极;
(2)H2CO3 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1=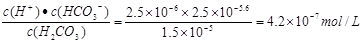 ;
;
(3)在常温下,在NaHCO3溶液中存在HCO3-的电离作用HCO3- CO32-+H+和HCO3-的水解作用HCO3-+H2O
CO32-+H+和HCO3-的水解作用HCO3-+H2O H2CO3 +OH-,电离使溶液显酸性,水解使溶液显碱性,由于0.1mol/L的NaHCO3溶液pH大于8,说明其水解作用大于电离作用,则溶液c(H2CO3)> c(CO32-)。
H2CO3 +OH-,电离使溶液显酸性,水解使溶液显碱性,由于0.1mol/L的NaHCO3溶液pH大于8,说明其水解作用大于电离作用,则溶液c(H2CO3)> c(CO32-)。
考点:考查燃料电池的各种原理、电离平衡常数的应用及盐的水解和电离的应用的知识。
本题难度:一般
5、选择题 某温度下,向一定体积的0.1mol/L醋酸溶液中逐滴加入0.1mol/LNaOH溶液,溶液中pOH【注:pOH=-lgc(OH-)】与pH的变化关系如图所示,则下列说法中正确的是

A.M点所示溶液中c(Na+)
参考答案:
本题解析:
本题难度:一般