微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大.以下是某温度下这四种酸在冰醋酸中的电离常数:

从以上表格判断以下说法中不正确的是?[???? ]
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4===2H++SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱
参考答案:C
本题解析:
本题难度:一般
2、选择题 常温下,有下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列有关说法正确的是
A.四种溶液的KW相同,由水电离的c(H+):①=③>②=④
B.向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>②>①
C.①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.将②、③两种溶液混合后,若pH=7,消耗溶液的体积为:③>②
参考答案:B
本题解析:
试题分析:A、因为①和②溶液中的水电离出的氢氧根离子浓度为10-12mol/L,③和④溶液中水的电离的氢离子浓度为10-12mol/L,,所以四种溶液中水的电离程度相同,不选A;B、③和④是碱,由于弱碱有电离平衡的移动,所以稀释相同倍数后,pH稍大些,①和②是酸,由于醋酸是弱酸,有电离平衡移动,所以稀释相同倍数后pH稍小些,所以溶液的pH的顺序为:③>④>②>①,正确,选B;C、三种溶液加入铝都可以反应生成氢气,但由于醋酸是弱酸,不完全电离,所以醋酸的浓度最大,产生的氢气最多,不选C;D、②和③混合符合pH加和等于14的酸碱等体积混合,谁弱显谁性,所以等体积混合后溶液显碱性,要得到中性溶液,则酸的体积要大些,不选D。
考点:强弱电解质的比较,溶液的pH的计算
本题难度:一般
3、选择题 下列叙述中,能证明某物质是弱电解质的是(??? )
A.水溶液的导电能力很弱
B.稀溶液中已电离的离子和未电离的分子共存
C.在水溶液中,存在分子
D.熔化状态时不导电
参考答案:B
本题解析:弱电解质指在水溶液或熔融状态能部分电离的化合物,电离后溶液中会存在已电离的离子;因为是部分电离,所以会有一些未电离的分子。A选项,强电解质如BaSO4在水中的溶解度很小而致导电能力很弱;C选项,非电解质蔗糖,在水溶液中也存在分子;D选项,强电解质HCl在熔化状态时也不导电。
本题难度:一般
4、选择题 在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是( )
A.图中五点Kw间的关系:B>C>A=D=E
B.C点一定是纯水
C.D点可能是醋酸溶液,E点可能是醋酸钠溶液
D.100℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
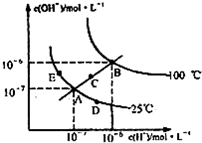
参考答案:B
本题解析:
本题难度:简单
5、选择题 分别在PH=1的酸溶液和PH=14的NaOH溶液中加入足量的铝,放出氢气的量前者多,其原因可能是:①两溶液的体积相同,而酸是多元强酸;②两溶液的体积相同,酸是弱酸;③酸溶液的体积比NaOH溶液体积大;④酸是强酸,且酸溶液的浓度比NaOH溶液浓度大;其中正确的为
A.只有②和③
B.只有②和④
C.只有①和③
D.只有①
参考答案:A
本题解析:PH=1的酸溶液和PH=14的NaOH溶液中,氢离子浓度和氢氧根离子浓度相等,加入足量的铝,放出氢气的量前者多,说明酸的物质的量大于NaOH的物质的量,有两种可能,一种是两溶液的体积相同,酸是弱酸;另一种是酸是强酸,且酸溶液的浓度比NaOH溶液浓度大,都导致酸的物质的量大于NaOH的物质的量,故选B.只有②和④。
本题难度:一般