微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下列反应在210℃达到平衡:
PCl5(g)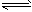 PCl3(g)+Cl2(g),其△H>0,K1=1 ①
PCl3(g)+Cl2(g),其△H>0,K1=1 ①
CO(g)+Cl2(g) COCl2(g) ,其△H<0,K2=5×104 ②
COCl2(g) ,其△H<0,K2=5×104 ②
COCl2(g) CO(g)+Cl2(g),其△H>0, K3=? ③
CO(g)+Cl2(g),其△H>0, K3=? ③
(1)根据反应①的平衡常数K的表示式,下列等式必定成立的是__________。
A. c(PCl5)=c(PCl3)=c(Cl2)=1
B. c(PCl5)=c(PCl3)+c(Cl2)=1
C. c(PCl5)=c(PCl3)c(Cl2)
(2)反应②和反应③的平衡常数K表达式_______(填“相同”或“不同”);K3=_______。
(3)降低Cl2浓度,反应③的平衡常数K3值将_______(填“增大”、“减小”或“不变”)
(4)要使反应①和反应②的K值相等,应采取的措施是_______。
A.反应①和反应②同时升高温度
B.反应①和反应②同时降低温度
C.反应①降低温度,反应②维持210℃
参考答案:(1)C
(2)不同;1/K2=2×10-5
(
本题解析:
本题难度:一般
2、选择题 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( ? )
A.反应I2(aq)+I-(aq)?I3-
(aq)的△H>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,可能有υ正>υ逆
D.状态A与状态B相比,状态A的c(I2)大
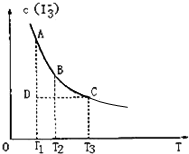
参考答案:BC
本题解析:
本题难度:简单
3、选择题 放热反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,其平衡常数为K1.升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( ? )
A.K2=K1
B.c2(CO)=c2(H2O)
C.K2>K1
D.c1(CO)>c2(CO)
参考答案:B
本题解析:
本题难度:一般
4、填空题 对于反应2L(g)+3M(g)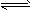 XQ(g)+3R(g),在容积为2L的密闭容器中,将2mol气体L和3mol气体M混合,当反应经2min后达平衡时生成2.4 mol气体R,并测得Q的浓度为0.4mol/L,则X的值为
XQ(g)+3R(g),在容积为2L的密闭容器中,将2mol气体L和3mol气体M混合,当反应经2min后达平衡时生成2.4 mol气体R,并测得Q的浓度为0.4mol/L,则X的值为
__________,L的转化率为__________,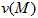 =___________,该反应的平衡常数K=______________。
=___________,该反应的平衡常数K=______________。
参考答案:1;80%;0.6mol/(L· min);640L/mol
本题解析:
本题难度:一般
5、简答题 Ⅰ:由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H<0
(1)该反应平衡常数K的表达式为______.温度降低,平衡常数K______(填“增大”、“不变”或“减小”).
(2)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)为______.
(3)下列措施中能使n(CH3OH)/n(CO2)增大的有______.
A.升高温度;B.加入催化剂;C.将H2O(g)从体系中分离;D.再充入1mol CO2和3mol H2;
E.充入He(g),使体系总压强增大.
(4)如图2所示,在甲、乙两容器中分别充入物质的量之比为1:3的CO2和H2,使甲、乙两容器初始容积相等.在相同温度下发生反应,并维持反应过程中温度不变.甲和乙相比,转化程度更大的是______,且知乙容器中CO2的转化率随时间变化的图象如图3所示,请在图3中画出甲容器中CO2的转化率随时间变化的图象.并请说明以CO2为原料生产燃料甲醇的优点是______(写出一条即可).
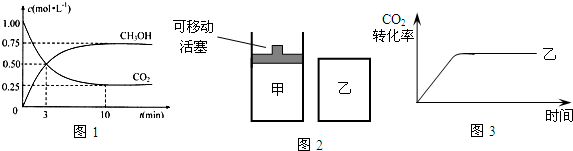
Ⅱ:一定常温下,FeS的KSP=2.5×10-18,H2S饱和溶液在该温度下,[H+]与[S2-]存在着以下关系:[H+]2?[S2-]=1.0×10-21.在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中[Fe2+]达到1mol/L,应调节溶液的pH为______(用对数形式表示).(写出计算过程)
参考答案:(1)已知CO2(g)+3H2(g)?CH3OH(g)+H2
本题解析:
本题难度:一般