微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 分析如下残缺的反应:RO3- +???+6H+=3R2↑ +3H2O。下列叙述正确的是
+3H2O。下列叙述正确的是
A.上式中缺项所填物质在反应中作氧化剂?
B.R的原子半径在同周期元素原子中最小
C.R一定是周期表中的第VA族元素
D.RO3-中的R元素在所有的反应中只能被还原
参考答案:B
本题解析:略
本题难度:一般
2、选择题 将3.3 gCO2通入含有3.7 gCa(OH)2的澄清石灰水中,可得沉淀
A.7.5 g
B.5 g
C.2.5 g
D.0.5 g
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列离子方程式中书写正确的是
A.氧化亚铁与稀盐酸反应:FeO+2H+=Fe3++H2O
B.碳酸钙和盐酸反应:
C.硫酸溶液和氢氧化钡溶液:
D.硝酸银溶液与氯化钠溶液反应:Ag++Cl-=AgCl↓
参考答案:D
本题解析:分析:A、不是氧化还原反应,生成的产物是亚铁离子,不是铁离子;
B、碳酸钙是难溶物,应该写成化学式,不能写成离子形式;
C、反应还原弱电解质水生成,不能漏掉;
D、阳离子和氯离子生成氯化银沉淀.
解答:A、生成的产物应该是亚铁离子,正确离子方程式是:FeO+2H+=Fe2++H2O,故A错误;
B、碳酸钙是难溶物,应该写成化学式,正确的离子方程式是:CaCO3+2H+═Ca2++CO2↑+H2O,故B错误;
C、漏掉了弱电解质水,正确的离子方程式是:SO42-+2H++Ba2+2OH-═BaSO4↓+2H2O,故C错误;
D、硝酸银和氯化钠反应的离子方程式是:Ag++Cl-=AgCl↓,故D正确;
故选D.
点评:本题考查了离子方程式的书写,注意不要漏项、难溶物、弱电解质写成化学式,本题难度不大.
本题难度:简单
4、选择题 下列解释实验现象的反应方程式不正确的是
A.金属Al放入NaOH?溶液中产生大量气泡:2Al+2OH-+2H2O=2AlO2-+3H2↑
B.将盛有二氧化氮气体的试管倒立在水中,气体变为无色,有液体进入试管:3NO2+H2O=2HNO3+NO
C.淀粉KI溶液与H2SO4酸化的H2O2溶液混合,溶液变蓝:2I-+H2O2+2H+=2H2O+I2
D.溶质物质的量之比为1:2的明矾溶液与Ba(OH)2溶液混合,生成白色沉淀:Al3++2SO42-+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓
参考答案:D
本题解析:分析:A、金属铝和强碱溶液反应生成偏铝酸盐和氢气;
B、二氧化氮和水反应生成硝酸和无色气体一氧化氮;
C、双氧水具有氧化性,能够将碘离子氧化成碘单质;
D、由于溶液中铝离子和氢氧根离子的物质的量之比是1:4,生成了偏铝酸根离子,没有氢氧化铝沉淀生成.
解答:A、铝和氢氧化钠溶液反应的化学方程式是:2Al+2OH-+2H2O=2AlO2-+3H2↑,故A错误;
B、二氧化氮和水反应的化学方程式是:3NO2+H2O=2HNO3+NO,故B错误;
C、双氧水能够氧化碘离子,反应的化学方程式是:2I-+H2O2+2H+=2H2O+I2,故C错误;
D、溶质物质的量之比为1:2的明矾溶液与Ba(OH)2溶液混合,溶液中铝离子和氢氧根离子的物质的量是1:4,生成了偏铝酸根离子,正确离子方程式是:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-↓+2H2O,故D正确;
故选D.
点评:本题考查了化学方程式的书写,注意D项铝离子和氢氧根离子的物质的量的关系,本题难度不大.
本题难度:困难
5、选择题 向10mL 0.1mol·L-1?NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是? (???? )
A.x=10时,溶液中有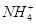 、
、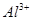 、
、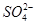 ,且
,且
B.x=10时,溶液中有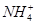 、
、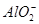 、
、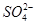 ,且
,且
C.x=30时,溶液中有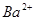 、
、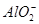 、
、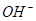 ,且
,且
D.x=30时,溶液中有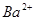 、
、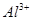 、
、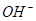 ,且
,且
参考答案:A
本题解析:
为了方便计算,可以把溶液的体积都扩大100倍,1000,mL 0.1mol·L-1?NH4Al(SO4)2溶液中含有0.1molNH4+ ,0.1mmolAL3+,0.2mmolSO42-,1000ml等浓度Ba(OH)2溶液有0.1mol Ba2+,0.2molOH-,混合后硫酸钡沉淀,剩余0.1mol SO42-。氢氧化铝沉淀,剩余AL3+,所以A答案对。由于氢氧根离子的物质的量小于AL3+3倍,所以溶液中还含有AL3+,没有 本题难度:一般
本题难度:一般