微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下
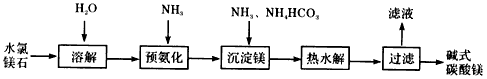
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6 mol/L,则溶液中c(Mg2+)=_____
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为_____________。
(3)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下
CO2 0.896L,通过计算确定碱式碳酸镁的化学式。
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数_________(填“升高”、“降低”或“不变”)。
参考答案:(1)2.0mol/L
(2)NH4Cl
(
本题解析:
本题难度:一般
2、填空题 工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
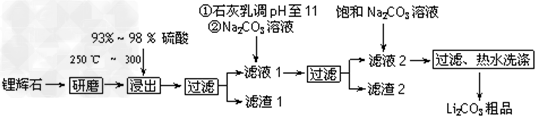
已知:①?Li2O·Al2O3·4SiO2?+H2SO4(浓)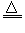 Li2SO4+Al2O3·4SiO2·H2O↓ ?
Li2SO4+Al2O3·4SiO2·H2O↓ ?
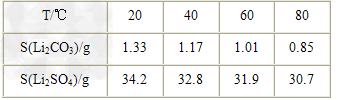
②?某些物质的溶解度(S)如下表所示。
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中反应的离子方程式是__________________________。
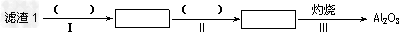
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)_______________________。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是__________________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①?a中,阳极的电极反应式是___________________。
②为什么要用离子选择透过膜隔开________________(任写一点)
③?b中,生成Li2CO3反应的化学方程式是__________________。
参考答案:(1)Al3++3NH3·H2O = Al(OH)3↓+3N
本题解析:
本题难度:一般
3、填空题 聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·xH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣--铝灰,它主要含
Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下
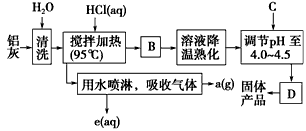
(1)搅拌加热操作过程中发生反应的离子方程式:________________、______________。
(2)生产过程中操作B和D的名称均为________(B和D为简单操作)。
(3)反应中副产品a是________(用化学式表示)。
(4)生产过程中可循环使用的物质是________(用化学式表示)。
(5)调节pH至4.0~4.5的目的是 __________________________。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程中C物质可选用__________
A.NaOH B.Al C.氨水 D.Al2O3 E.NaAlO2
参考答案:(1)Al2O3+6H+==2Al3++3H2O;2Al+6
本题解析:
本题难度:一般
4、填空题 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺:
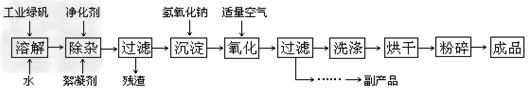
已知:
①?工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应; ?
②??Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O???
③??12.16×1000×52.5%=6384,?6384/152=42
请回答下列问题:
(1)铁的常见氧化物有____________;
(2)Fe3O4与稀硝酸反应的离子方程式是_______________________,检验反应后的溶液中含Fe3+的方法______________________;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是___________________;
(4)生产中可获得的副产品是_______,提取该副产品的操作顺序是____________?(填写序号)
a.过滤????b.加热浓缩????c.冷却????d.结晶????e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16?kg/h,为使产品较纯,鼓入空气的速率应为________?L/h(假设反应在标准状态下进行,空气中O2占20%)。
参考答案:
(1)FeO、Fe2O3、Fe3O4?
(2)3
本题解析:
本题难度:一般
5、选择题 金属陶瓷是一种应用于高科技的复合材料,合成方法是将陶瓷(主要成分:Al2O3、ZrO2等耐高温材料)和粘结金属(主要是Cr、Mo、W、Ti等高熔点金属)研磨混匀成型后,高温烧结使金属仍然以单质的形式存在于金属陶瓷之中,据此判断合成工艺必须 [???? ]
A. 在氧气中合成
B. 在HCl气氛中合成
C. 在氮气气氛中合成
D. 在空气中合成
参考答案:C
本题解析:
本题难度:简单