微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法或表示方法中正确的是 [???? ]
A.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多
B.反应热的大小与反应物的多少无关
C.已知强酸与强碱反应的中和热为57.3 kJ·mol-1,若将含0.5mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量要大于57.3 kJ
D.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l);△H<0
参考答案:C
本题解析:
本题难度:一般
2、填空题 25℃时,0.1 mol·L-1的某酸HA溶液中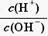 =1010,请回答下列问题:
=1010,请回答下列问题:
(1)HA是???酸(填“强”或“弱”),写出其电离方程式????????????????????????????。
(2)在加水稀释HA的过程中,随着水量的增加而减小的是________(填字母)。
A.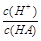
B.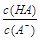
C.c(H+)·c(OH-)
D.c(OH-)
(3)已知100℃时水的离子积是1.0×10—12,在此温度下,有pH=3的盐酸和pH=3的HA的两种溶液
①取等体积两溶液,分别稀释到pH=4时,两者加水量的关系是:前者________后者(填>、<或=,下同);
②取等体积的两溶液,分别加入等物质的量的相应钠盐固体少量,两溶液的pH大小关系是:前者________后者;
③50mL pH=3的盐酸溶液和50mL 0.003mol/LNaOH溶液混合后溶液的pH=_____________.
④pH=3的HA溶液中由水电离出的c(H+)=??????????????????mol/L
(4)如何通过化学实验来证明HA是弱酸还是强酸,请写出其中的一种化学实验方法:
???????????????????????????????????????????????????????????????????????????????
?????????????????????????????????????????????????????????????????????????????。
参考答案:(1)弱????? HA 本题解析:
本题解析:
试题分析:(1)25℃时,Kw=10-14,由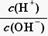 =1010得c(H+)="0.01" mol·L-1,c(HA)=" 0.1" mol·L-1,所以HA是弱酸。
=1010得c(H+)="0.01" mol·L-1,c(HA)=" 0.1" mol·L-1,所以HA是弱酸。
(2) 本题难度:简单
本题难度:简单
3、选择题 在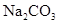 溶液中,下列等量关系成立的是(???)
溶液中,下列等量关系成立的是(???)
A.c(OH-)= c(H+)+c(HCO3-)+2c(H2CO3)
B.2c(Na+)= c(CO32-)+ c(HCO3-)+ c(H2CO3)
C.c(Na+)+ c(H+)= c(HCO3-) +2c(CO32-)+ c(OH-)
D.c(Na+)="2" c(CO32-)+ c(HCO3-)+ c(H2CO3)
参考答案:AC
本题解析:
试题分析:在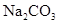 溶液中,根据电荷守恒,可得到c(Na+)+ c(H+)= c(HCO3-) +2c(CO32-)+ c(OH-),故C正确,根据物料守恒,可得到c(Na+)="2" c(CO32-)+2 c(HCO3-)+ 2c(H2CO3),所以BD错误,将c(Na+)="2" c(CO32-)+2 c(
溶液中,根据电荷守恒,可得到c(Na+)+ c(H+)= c(HCO3-) +2c(CO32-)+ c(OH-),故C正确,根据物料守恒,可得到c(Na+)="2" c(CO32-)+2 c(HCO3-)+ 2c(H2CO3),所以BD错误,将c(Na+)="2" c(CO32-)+2 c(
本题难度:简单
4、选择题 下列说法或表示方法中正确的是[???? ]
A.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多
B.氢气的燃烧热为285.5?kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)===2H2O(l) ΔH=-285.8?kJ/mol
C.Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0
D.已知中和热为57.3?kJ/mol,若将含?0.5?mol?H2SO4的浓溶液与含1?mol?NaOH的溶液混合,放出的热量要大于57.3?kJ
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列属于未来新能源的是
①天然气??②煤??③核能??④石油??⑤太阳能??⑥生物质能??⑦风能??⑧氢能
A.①②③④
B.⑤⑥⑦⑧
C.③⑤⑥⑦⑧
D.③④⑤⑥⑦⑧
参考答案:C
本题解析:①天然气、②煤?、④石油为三大化石燃料,属于常规能源,非两生能源;
本题难度:一般