微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 S2Cl2是橙黄色液体,少量泄漏会产生室息性气味的气体,喷水雾可减慢挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2Cl2的说法错误的是
 [???? ]
[???? ]
A.为非极性分子
B.分子中既含有极性键又含有非极性键
C.与S2Br2结构相似,熔沸点S2Br2>S2Cl2
D.与水反应的化学方程式可能为2S2Cl2+2H2O=SO2↑+3S↓+4HCl
参考答案:A
本题解析:
本题难度:一般
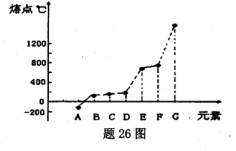
2、填空题 (14分)下表所示的是第二周期元素中,除Be、B、Ne三种元素外,其它元素的简单氢化物的沸点;题26图所示是第三周期元素中,除Ar以外的其它元素的单质的熔点变化关系。
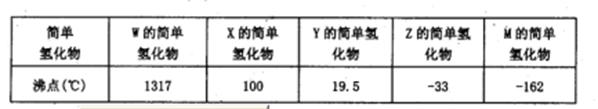
(1)X的简单氢化物属于????????????分子(填“极性”或“非极性”),G元素的单质在固态时的晶体类型为___????????????_。
(2)写出W的氢化物的电子式?????????______。
(3)A和Z两元素形成的一种化合物分子中各原子最外均达到8电子稳定结构,则该分子的结构式为???????????????。
(4)化合物AY能与水反应生成两种弱酸,其化学方程式为????????????
(5)写出元素F的单质与三氧化二铬反应的化学方程式___????????????
参考答案:(1)极性(2分),原子晶体(2分)??(2)Li+[:H]
本题解析:(1)X的氢化物的沸点是100℃,所以X是水,属于极性分子。G单质的熔点最高,应该是单质硅,属于原子晶体。
(2)W的氢化物最高,应该是离子化合物,而在第二周期中能析出离子晶体的是LiH,电子式为Li+[:H]-。
(3)A的熔点最低,应该是氯气。Z的氢化物沸点仅比M的氢化物沸点高,所以Z是氮元素。由于化合物分子中各原子最外均达到8电子稳定结构,所以是NCl3,结构类似于氨气,所以结构式为 本题难度:一般
本题难度:一般
3、填空题 (13分) 四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素
| A
| B
| C
| D
|
性质
结构
信息
| 原子核外有两个电子层,最外层有3个未成对的电子
| 原子的M层有1对成对的p电子
| 原子核外电子排布为[Ar]3d104s1,
有+1、+2两种常见化合价
| 有两种常见氧化物,其中有一种是冶金工业常用的还原剂
⑴写出B原子的电子排布式?????????。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点?????(填“高”或“低”),其是__________________________。
⑶D的最高价氧化物的电子式:?????????????。高温下D的氧化物还原赤铁矿的方程式为可逆反应,写出该反应的化学方程式___________________,该反应的平衡常数表达式K=___________。
⑷往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为________________,简要描述该配合物中化学键的成键情况__________________。
⑸下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。 ”表示没有形成共价键的最外层电子,短线表示共价键。
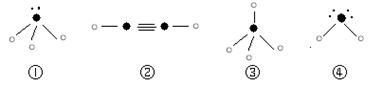
则在以上分子中,中心原子采用sp3杂化形成化学键的且空间构型是角形的是??????(填写序号);在②的分子中有???????个σ键和????????个π键。
⑹已知NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为 sup10(∣←N-,sup10(∣H(→表示共用电子对由N原子单方面提供)。 请画出N4H44+的结构式_____________________。
参考答案:⑴ 1s22s22p63s23p4?(1分)
⑵高,因
本题解析:
试题分析:B原子的M层有1对成对的p电子,说明M层电子数是4,所以B原子的电子排布式1s22s22p63s23p4 ??;,
A原子核外有两个电子层,最外层有3个未成对的电子所以A原子L层电子数是5即是N原子,A元素的氢化物的沸点比同主族相邻元素氢化物沸点高,因为A的氢化物存在氢键;
D有两种常见氧化物,其中有一种是冶金工业常用的还原剂,是CO所以D的最高价氧化物的电子式 本题难度:一般 本题难度:一般
4、填空题 (13分) 下表为元素周期表的一部分,其中编号代表对应的元素。

请回答下列问题:
(1)写出元素⑦的基态原子排布式????????????????????,元素⑧位于???????区。
⑤元素原子的价层电子的轨道表示式为????????????????????????????????,
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为?????和????。
(3)元素④和⑥的第一电离能大小顺序是??????>???????(用元素符号表示)。请写出由④和⑤两种元素形成的与N3-互为等电子体的离子的化学式???????????,其VSEPR构型为???????????。
(4)在测定①和⑥形成的化合物的相对分子质量时,实验测得值一般高于理论值,其主要原因是???????????????????????????????????。
(5)④和⑧形成某种化合物的晶胞结构如右图所示(每个球均表示1个原子,其中④显-3价),则其化学式为???????????。
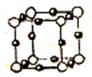
⑧的常见离子和④的最简单氢化物形成的配离子的名称为??????????????,
其水溶液颜色为??????????????????。
参考答案:(1)1s22s22p63s23p63d54s1(1分)?
本题解析:根据元素在周期表中的位置可知,①~⑧分别是H、Be、C、N、O、F、Cr、Cu。
(1)根据构造原理可知,Cr的基态原子排布式为1s22s22p63s23p63d54s1。区的名称来自于按照构造原理最后填入电子能极的轨道名称,所以根据构造原理可知,Cu位于ds。同样根据构造原理可知,氧原子的价层电子的轨道表示式为 本题难度:一般 本题难度:一般
5、选择题 HgCl2稀溶液可用作外科手术的消毒液。已知其熔点是227℃,不能导电,HgCl2稀溶液有弱的导电能力。 则下面关于HgCl2叙述不正确的是[???? ]
A.HgCl2是电解质
B.HgCl2是盐,属离子化合物
C.HgCl2固体是分子晶体
D.HgCl2是盐,属共价化合物
参考答案:B
本题解析:
本题难度:简单
|