微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对下列实验的描述正确的是
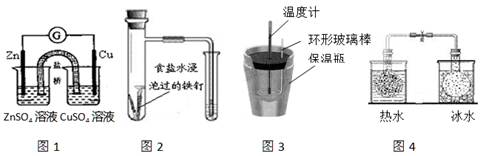
A.图1所示的实验:根据检流计(G)中指针是否偏转即可比较Zn、Cu的金属活泼性
B.图2所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀
C.图3所示的实验:根据温度计读数的变化测定稀硫酸和NaOH溶液反应的反应热
D.图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g) N2O4(g)是吸热反应
N2O4(g)是吸热反应
参考答案:C
本题解析:
试题分析:A项:两个烧杯中的溶液不溶,不能比较,故错;B项:是吸氧腐蚀,故错;D项:反应为放热反应,故错。故选C。
点评:本题考查的知识比较综合,题目难度中等,学习中注意相关基础知识的积累,此类题目可轻松解答。
本题难度:简单
2、选择题 下列事故处理不正确的是( )
A.不慎碰倒酒精灯,洒出的酒精在桌上燃烧时,应立即用湿抹布扑盖
B.将一氧化碳中毒者移到通风处抢救
C.眼睛里不慎溅进了药液,应立即用水冲洗,边洗边眨眼睛,不可用手揉眼睛
D.不慎将浓硫酸溅到皮肤上,应立即用水冲洗
参考答案:D
本题解析:略
本题难度:简单
3、选择题 下列实验操作错误的是???????????????????????????????? ( )
A.蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口附近
B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸
D.称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中
参考答案:C
本题解析:A正确,蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口附近;B正确,分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出;C错,量筒不能用于配制溶液,只能用于量取液体;D正确,称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中;
本题难度:一般
4、计算题 草酸是一种重要的试剂。下面是利用草酸探究浓度对反应速率影响的实验。
(1)为证明浓度对反应速率的影响,曾有教科书《化学反应原理》设计了如下实验:取两支试管,各加入4mL0.01mol·L-1的KMnO4酸性溶液,分别向其中加入0.1 mol·L-1、0.2 mol·L-1 H2C2O4溶液2mL,记录溶液褪色所需时间。
实验中发生反应的离子方程式为:?????;
预期现象是:
①溶液的颜色由?????色变为?????色,
②其中加入?????mol·L-1H2C2O4的那支试管中的溶液先变色。
然而实验结果并不尽如人意。实验过程颜色复杂,且褪色先缓慢,后逐渐加快;最大的问题是草酸浓度大,反应速率却更慢。
本实验能否作为课堂实验研究浓度对化学反应速率的影响?适宜的条件是怎样的?某校一研究小组对此进行了探究。下面是他们的实验报告的一部分:
表1 试验安排及结果
实验
编号
| A(KMnO4溶液浓度/mol·L-1)
| B(草酸溶液浓度/mol·L-1)
| C(硫酸溶液浓度/mol·L-1)
| 褪色时间/s
|
1
| 3
| 3
| 1
| 336
|
2
| 1
| 2
| 3
| 82
|
3
| 3
| 1
| 3
| 76
|
4
| 1
| 3
| 2
| 133
|
5
| 2
| 3
| 3
| 102
|
6
| 3
| 2
| 2
| 156
|
7
| 2
| 2
| 1
| 300
|
8
| 2
| 1
| 2
| 115
|
9
| 1
| 1
| 1
| 200
|
?
应用SPSS16.0对正交试验结果进行方差分析,结果如下表
表2 各因素水平的数据处理结果
?
| A(KMnO4溶液)
| B(草酸溶液)
| C(硫酸溶液)
|
浓度/mol·L-1
| 0.005
| 0.010
| 0.015
| 0.1
| 0.5
| 0.9
| 6
| 12
| 18
|
平均褪色时间/s
| 138.3
| 172.3
| 189.3
| 130.3
| 179.3
| 190.3
| 278.7
| 134.7
| 86.7
|
?
(2)由表2可知,三因素中,?????的浓度(选填“A、B或C”,下空同)对反应速率影响显著,而?????的浓度对反应速率的影响不显著。
(3)由表2可知,当高锰酸钾浓度为?????mol·L-1、草酸浓度为?????mol·L-1时,反应最快。即因素A、B的较适宜实验条件得以确定。
根据以上实验结果,该小组同学继续探究硫酸的浓度是怎样影响本反应速率的,测得如下实验结果:
表3 不同硫酸浓度下的褪色时间
c(H2SO4)/mol·L-1
| 18
| 16
| 14
| 12
| 10
| 8
| 6
|
褪色时间/s
| 67
| 83
| 90
| 103
| 129
| 146
| 200
|
?
(4)根据课堂实验的合适时间,可选溶液的褪色时间约为1分钟和2分钟的两份溶液,即此时硫酸的浓度为?????mol·L-1和?????mol·L-1,这也有利于观察这两个反应速率的差异。
结论:草酸与酸性高锰酸钾溶液的反应,可作为课堂实验探究浓度对反应速率的影响。
参考答案:(14分)
(1)2MnO4-+5H2C2O4+6H+
本题解析:
试题分析:
(1)高锰酸钾具有氧化性、草酸具有还原性,MnO4-将H2C2O4氧化为CO2气体,本身被还原为Mn2+,根据得失电子相等、电荷守恒、质量守恒配平。MnO4-呈紫色,反应后溶液为无色。增大反应物浓度,反应速率加快。
(2)由表2可知,硫酸浓度对反应速率影响显著;而高锰酸钾和草酸浓度对反应速率影响不明显。
(3)当高锰酸钾溶液浓度为0.005 mol·L-1、草酸溶液浓度为0.01 mol·L-1时反应速率最快。
(4)褪色时间1分钟和2分钟即60s和120s,对应的浓度分别为18 mol·L-1和10 mol·L-1。
本题难度:一般
5、选择题 下列药品保存方法不正确的是
A.浓HNO3和AgNO3溶液都要避光密封保存
B.保存氯化铁和氯化亚铁试剂都要加盐酸和铁粉
C.少量的金属钠、钾、白磷和液溴都要用液封法保存
D.碱性较强的溶液都要保存在配有胶塞的细口试剂瓶中
参考答案:B
本题解析:A正确,浓HNO3和AgNO3溶液不稳定受热易分解;B不正确,保存氯化铁试剂时需加少量稀盐酸抑制氯化铁的水解;而保存氯化亚铁试剂既加加少量稀盐酸抵制水解,同时又要加少量铁粉防止二价铁离子被氧化为三价铁离子。C正确,钠、钾、白磷均易被空气中的氧气氧化,而液溴易挥发,所以均要液封法保存。D正确,试剂的成分中有二氧化硅,二氧化硅能与强碱反应。
本题难度:一般