微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围
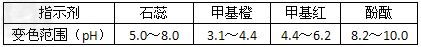
(1)向锥形瓶中移取一定体积的白醋所用的仪器是_____,该实验最佳应选用_________作指示剂,达到滴定终点的实验现象是__________________?。
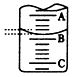
(2)下图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为______mL,此时滴定管中液体的体积_________?。
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c?mo1/L,三次实验结果记录如下
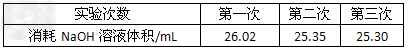
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是__________________????????
A.实验结束时俯视滴定管中液面,读取滴定终点时NaOH溶液的体积
B.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
C=_______________。
2、简答题 现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
Ⅰ.实验步骤:
(1)用______(填仪器名称)量取10.00mL食用白醋,在______(填仪器名称)中用水稀释后转移到100mL______(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴______作指示剂.
(3)读取盛装0.1000mol/L?NaOH?溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为______mL.
(4)滴定.当______时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
滴定次数
实验数据(mL) | 1 | 2 | 3 | 4
V(样品)
20.00
20.00
20.00
20.00
V(NaOH)(消耗)
15.95
15.00
15.05
14.95
Ⅲ.数据处理与讨论:
(1)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积?V=15.95+15.00+15.05+14.95
4
mL=15.24mL.
指出他的计算的不合理之处:______.
按正确数据处理,可得c(市售白醋)=______mol/L;市售白醋总酸量=______g/100mL.
(2)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的______(填写序号).
a.pH??? b.电离度??? c.电离常数??? d.溶解度
(3)在本实验的滴定过程中,下列操作会使实验结果偏大的是______(填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.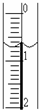
3、选择题 用已知物质的量浓度的NaOH溶液测定未知物质的量浓度的盐酸,其操作错误的是( )
A.酸式滴定管需用待测盐酸润洗
B.碱式滴定管不用标准碱液润洗
C.滴定过程中不能有液体从锥形瓶溅出
D.滴定结束,读数时要平视读数
4、简答题 有些化学反应进行时观察不到明显的现象.某兴趣小组为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计如下方案.
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸并不断振荡,同时测定混合溶液的pH,若测得pH逐渐变小且小于7,证明NaOH与稀盐酸发生了中和反应.
(1)用pH试纸测定溶液的pH时,正确的操作是:______.
(2)简述强调“测得的pH小于7”的理由:______.
方案二:在NaOH溶液中滴加几滴酚酞,溶液显红色,再滴加稀盐酸,红色逐渐消失,证明NaOH溶液与稀盐酸发生了中和反应.但该组同学在向NaOH溶液中滴加酚酞时发现氢氧化钠溶液中滴入酚酞后,溶液变成了红色,过了一会儿红色消失.该小组对这种意外现象的原因作如下猜想:
①可能是酚酞被空气中的氧气氧化,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失.
(1)为验证猜想①,将配制的氢氧化钠溶液加热,在液面上滴一些植物油,冷却后向溶液中再滴入酚酞.“加热”和“滴入植物油”目的是______.结果表明红色消失与空气中的氧气无关.
(2)为验证猜想②,取一定量的Na2CO3溶液,向其中滴入酚酞,发现溶液呈现红色,得出以下结论:
结论1:说明Na2CO3溶液呈______性;
结论2:说明溶液红色消失与空气中的二氧化碳无关.
(3)通过查阅资料得知:酚酞在氢氧化钠溶液浓度很大时 ,可能重新褪至无色.请设计实验方案证明红色消失的原因是取用的NaOH溶液浓度过大:实验方法:______,观察到的现象:______.
5、选择题 下列有关的叙述正确的是? [???? ]
A.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
B.实验室可用NaOH溶液处理NO2和HCl废气
C.酸碱滴定时,若加入待测液前用待测液润洗锥形瓶,对测定结果无影响
D.依据丁达尔现象可将分散系分为溶液、胶体与浊液
|
|