微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 有一透明溶液甲,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Ba2+、SO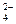 、Cl-、I-、HCO
、Cl-、I-、HCO ,现取该溶液实验如下:
,现取该溶液实验如下:
实验步骤
| 实验现象
|
①取少量甲溶液,滴加几滴甲基橙
| 溶液变红色
|
②取少量甲溶液,滴加Ba(NO3)2溶液
| 溶液无明显变化
|
③取②中实验后的溶液,滴加AgNO3溶液
| 有白色沉淀生成,且不溶于HNO3
|
④取少量甲溶液,滴加NaOH溶液
| 有白色沉淀生成,当NaOH过量时沉淀部分溶解
(1)由实验步骤①判断出溶液中肯定不存在的离子是 ,能说明这一实验事实的离子方程式是
(2)实验步骤③的实验结果说明溶液中不存在 离子
(3)欲确定的离子中肯定存在的是 。
(4)为进一步确定其他离子,应该补充的实验是
A.蒸发
B.过滤
C.焰色反应
D.渗析
参考答案:(1)HCO 本题解析:略 本题解析:略
本题难度:一般
2、选择题 下列各组物质的分类正确的是( )
①混合物:氯水、氨水、水玻璃、水银、福尔马林、聚乙烯②电解质:明矾、冰醋酸、石膏、纯碱
③CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物 ;④同位素:1 H+、2H2、3H
⑤同素异形体:C60、C80、金刚石、石墨 ; ⑥同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑦同分异构体:乙二酸二乙酯、乙二酸乙二酯
⑧根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
⑨在熔化状态下能导电的化合物为离子化合物
A.②⑤⑨
B.①②⑤⑦⑨
C.②⑤⑥⑦⑨
D.全部正确
参考答案:A
本题解析:
试题分析:①氯水、氨水、水玻璃、福尔马林、聚乙烯是混合物,而水银是纯净物,错误;②明矾、冰醋酸、石膏、纯碱都是电解质,正确;③NO2、不是酸性氧化物, Na2O2不是碱性氧化物,错误;④同位素应该是质子数相同,而中子数不同的原子,1 H+表示1个氢离子,2H2表示2个氢分子,3H表示3个氢原子,所以不是同位素,错误;⑤ C60、C80、金刚石、石墨是同种元素组成的不同性质的单质,互称同素异形体,正确;⑥ CH2O2、C2H4O2、C3H6O2、C4H8O2分子式都符合CnH2nO2,符合该通式的可能是饱和一元羧酸,也可能是酯,所以不一定是同系物,错误;⑦乙二酸二乙酯、乙二酸乙二酯分子式不同,所以二者不是同分异构体,错误;⑧根据酸分子电离产生的H原子个数将酸分为一元酸、二元酸、多元酸,错误;⑨在熔化状态下能导电的化合物为离子化合物,正确。物质的分类正确的②⑤⑨,正确选项是A。
考点:考查物质分类正确性判断的知识。
本题难度:一般
3、选择题 下列物质中,属于电解质的是( )
A.H2
B.Al
C.CH4
D.H2SO4
参考答案:D
本题解析:电解质首先是化合物,并且是在水中或熔融状态下可导电的化合物;
本题难度:简单
4、填空题 (1)只用一种试剂即可除去少量杂质和鉴别物质。将其填在空格处。
编号
| 物质
| 试剂名称或化学式
| ①
| 除杂质:NaHCO3溶液(Na2CO3)
|
| ②
| 除杂质:SiO2(CaCO3)
|
| ③
| 除杂质:FeCl2溶液(FeCl3)
|
| ④
| 鉴别:Na2CO3 Na2SiO3 Na2SO3溶液
|
| ⑤
| 鉴别:(NH4)2SO4 NH4C1 Na2SO4溶液
|
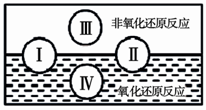
(2)氧化还原是常见的反应类型,根据信息回答以下问题: “四种基本反应类型与氧化还原反应的关系”也可用下图表达。其 中Ⅰ为化合反应,则Ⅱ为 反应。写出一个有水生成的符合反应类型Ⅲ的化学方程式: 。写出一个有水参加的符合反应类型Ⅳ的化学方程式 ,其中水作为 剂。(填氧化剂、还原剂等)
(3)将SO2和Cl2按1:1体积比(同温同压)混合后通入品红溶液中,溶液不褪色。经实验证明,SO2和Cl2在溶液中发生了氧化还原反应,且SO2被氧化,该反应的离子方程式是 。
参考答案:(1)①二氧化碳 ②盐酸 ③ 铁屑 ④
本题解析:
试题分析:(1)①Na2CO3与CO2、H2O反应生成NaHCO3,所以加入CO2可除去杂质Na2CO3。
②盐酸与CaCO3反应生成CaCl2、CO2和H2O,所以加入盐酸可除去CaCO3。
③Fe与FeCl3反应生成FeCl2,所以加入Fe可除去FeCl3。
④加入盐酸生成无色无味气体的溶液是Na2CO3,生成无色刺激性气味气体的溶液是Na2SO3,生成白色沉淀的溶液是Na2SiO3。
⑤加入Ba(OH)2溶液,只生成白色沉淀的溶液是Na2SO4,只生成刺激性气味气体的溶液是NH4Cl,既生成白色沉淀,也生成刺激性气味气体的溶液是(NH4)2SO4.
(2)化合反应与分解反应部分属于氧化反应,部分属于非氧化反应;类型Ⅲ为复分解反应,生成H2O的反应都可以,如酸碱中和反应:HCl+NaOH=NaCl+H2O;反应类型Ⅳ是置换反应,有H2O参加反应如:2Na+2H2O=2NaOH+H2↑,水为氧化剂。
(3)Cl2与SO2、H2O反应生成H2SO4和HCl,离子方程式为:SO2+C12+2H2O===4H++SO42-+2Cl-
考点:本题考查物质的鉴别和除杂、基本反应类型与氧化还原反应、离子方程式的书写。
本题难度:一般
5、选择题 溶液中,下列电离方程式正确的是
A.KAl (SO4)2=K++Al3++2SO
B.H2CO3=H++HCO
C.Ca(HCO3)2=Ca2++2H++2CO
D.Ba(OH)2=Ba2++OH2-
参考答案:A
本题解析:
试题分析:A、对于强电解质溶液,用“=”号,硫酸铝钾属于强电解质;B、碳酸属于弱电解质,用可逆符号;C、电离生成钙离子、碳酸氢根离子;D、电离生成钡离子和2个氢氧根离子;所以答案选A
考点:考查电离方程式书写的相关知识点。
本题难度:简单
|
|