微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以NA代表阿伏加德罗常数,则关于热化学方程式:C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);
ΔH=-1300kJ/mol的说法中,错误的是 [???? ]
A.有10NA个电子转移时,放出1300kJ的能量
B.有4NA个碳氧共用电子对生成时,放出1300kJ的能量
C.C2H2的燃烧热为1300kJ/mol
D.该热化学方程式还可表示为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2600 kJ/mol
参考答案:B
本题解析:
本题难度:简单
2、填空题 (8分)甲醇(CH3OH)被称为21世纪的新型燃料,以煤为原料制备甲醇的流程如下:

(1) 气化炉中主要反应的化学方程式为 。
(2)已知CO、H2、甲醇(l)的燃烧热分别为:—285.8 kJ/mol、—283 kJ/mol、—726.5 kJ/mol;
则CO和H2合成甲醇的热化学方程式为__ __
(3) -定条件下,在催化反应室中发生反应.CO(g)+2H2(g) =CH3OH(g)△H<0;
CO 的平衡转化率与温度、压强的关系如图所示。回答下列问题:
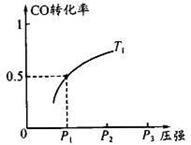
①工业上,上述反应温度不宜过高,原因是_ ___;
②若反应是1 mol CO与2 mol H2在2L容积中进行,则
T1、P1下,该反应的平衡常数为__ __;
维持温度、容积不变,催化反应室再增加l mol CO与2 mol
H2,达到新平衡时,CO的转化率____(填“增大”、“减小”或“不变”)。
参考答案:(1)C+ H2O (g) 本题解析:
本题解析:
试题分析:(1)气化炉中发生的反应是生成水煤气的反应,化学方程式为C+ H2O (g) CO+H2
CO+H2
(2)CO和H2合成甲醇的化学方程式为CO(g)+2H2(g)=CH3OH(l),该反应的反应热△H与CO、H2、甲醇(l)的燃烧热的关系是△H="—285.8" kJ/mol+2×(—283 kJ/mol)-(—726.5 kJ/mol)=-125.3kJ/mol,所以CO和H2合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l) △H=-125.3kJ/mol;
(3)①该反应放热,温度过高,不利于正反应的进行,甲醇的产率降低;
②T1、P1下,CO的转化率是50%,所以平衡时甲醇的浓度为1mol/2L×50%=0.25mol/L,CO的平衡浓度也是0.25mol/L,氢气的平衡浓度是CO的2倍0.5mol/L,所以该条件下的平衡常数K=0.25mol/L/0.25mol/L×0.52mol/L=4(L/mol)2;维持温度、容积不变,催化反应室再增加l mol CO与2 molH2,CO与H2的比例与原平衡相同,等效为增大压强,平衡向体积减小的方向移动,即向正反应移动,CO的转化率增大。
考点:考查化学反应与能量的关系,化学平衡理论的应用
本题难度:困难
3、选择题 313 K时,水的KW=3.0×10-14,则在313 K时,c(H+)=10-7 mol/L的溶液(??)
A.呈酸性
B.呈中性
C.呈碱性
D.无法判断
参考答案:C
本题解析:解答本题时应注意以下两点:
(1)判断溶液的酸碱性最根本的依据是溶液中c(H+)与c(OH-)的相对大小;
(2)根据水在一定温度下的KW可以通过计算确定溶液呈中性时的c(H+)。
本题难度:一般
4、选择题 常温下,现有pH=3的某酸HX溶液和pH=11某碱YOH溶液,两溶液混合后,溶液的pH小于7。下表中判断合理的是(???)
编号
| HX
| YOH
| 溶液的体积关系
|
A[
| 强酸
| 强碱
| V(HX)=V(YOH)
|
B
| 强酸
| 强碱
| V(HX)<V(YOH)
|
C
| 强酸
| 弱碱
| V(HX)=V(YOH)
|
D
| 弱酸
| 强碱
| V(HX)=V(YOH)
参考答案:D
本题解析:若都为强酸和强碱,则其浓度均是0.001mol·L-1,等体积混合,溶液呈中性,A不正确,若酸的体积小于碱的体积,则碱过量,溶液呈碱性,B不正确。若碱是弱碱,则其浓度大于0.001mol·L-1,因此当等体积混合时,碱仍然过量,溶液呈碱性,C不正确。如果酸是弱酸,则酸的浓度将大于0.001mol·L-1,当等体积混合时,酸过量,溶液呈酸性,D不正确。
本题难度:简单
5、选择题 下列叙述正确的是
A.95 ℃纯水的pH<7,说明加热可导致水呈酸性
B.0.2 mol·L-1的盐酸与等体积水混合后pH = 1(忽略体积的变化)
C.pH = 3的醋酸溶液稀释至10倍后pH = 4
D.Na2CO3溶液中:c(Na+) + c(H+) = c(HCO3-) +c(CO32-) + c(OH-)
参考答案:B
本题解析:A不正确,水是弱电解质,加热促进电离,pH减小,纯水还是显中性的。盐酸是强酸,稀释后的浓度是0.1mol/L,所以溶液的pH=1,B正确。醋酸是弱酸,稀释促进电离,即稀释后氢离子的物质的量是增加的,所以稀释10倍后的pH小于4,C不正确。D不正确,不符合电荷守恒定律,应该是c(Na+) + c(H+) = c(HCO3-) +2c(CO32-) + c(OH-),答案选B。
本题难度:一般
|