微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、判断题 如下图中①—11分别代表有关反应物中的一种物质,请填写以下空白。
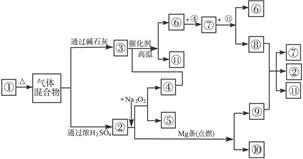
(1)①③④的化学式分别是___________、___________、___________。
(2)⑧与⑨反应的化学方程式是________________________________________________。
(3)②与Mg条(点燃)反应的化学方程式为:__________________________________。
参考答案:(1)NH4HCO3? NH3? O2
(2)C+4H
本题解析:由②+Mg ⑨+⑩,想到中学化学的典型反应CO2+2Mg====C+2MgO知②为CO2(突破口)
⑨+⑩,想到中学化学的典型反应CO2+2Mg====C+2MgO知②为CO2(突破口)
由:②+Na2O2 ④+⑤,且②为CO2知④、⑤为Na2CO3和 O2
④+⑤,且②为CO2知④、⑤为Na2CO3和 O2
由:③+④ ⑥+?B11?,知④为O2则⑤为Na2CO3,③为NH3。
⑥+?B11?,知④为O2则⑤为Na2CO3,③为NH3。
其余依次推出:①为(NH4)2CO3或NH4HCO3,⑥为NO,⑦为NO2,
⑧为HNO3,⑨为C,⑩为MgO,?B11?为H2O。
本题难度:简单
2、实验题 (8分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用带刻度的集气瓶排水法收集氢气,每隔1分钟记录一次数据(累计值):
时间(min)
| 1
| 2
| 3
| 4
| 5
|
氢气体积(mL)
| 50
| 120
| 232
| 290
| 310
(1)从0~3分钟时间段内,产生氢气的速率是如何变化的?答:????????????????????。
造成这种变化的主要因素是????????????????????;从3~5分钟时间段内,产生氢气的速率是如何变化的?答:????????????????????。造成这种变化的主要因素是????????????????????。
(2)在盐酸中分别加入等体积的下列溶液,能减缓反应速率而又不减少产生氢气的量的是???????????????。
A.蒸馏水???????? B.NaCl溶液??????? C.Na2CO3溶液??????? D.CuSO4溶液
(3)在0~1、1~2、2~3、3~4、4~5分钟五个时间段中,反应速率最大的时间段的盐酸的反应速率为?????????????????(设溶液体积不变,上述气体体积为标况下数据)。
参考答案:(1)反应速率逐渐增大(1分);锌与盐酸反应放热,使溶液温度
本题解析:(1)根据表中数据可知,在0~1、1~2、2~3内生成的氢气分别是(ml)50、70、112,所以反应速率逐渐增大,这是由于锌与盐酸反应放热,使溶液温度升高,反应速率增大。在3~4、4~5内生成的氢气分别是(ml)58、20,所以反应速率逐渐减小,这是由于随着反应进行,c(H+)逐渐减小,反应速率逐渐减小。
(2)稀释能降低氢离子浓度,但不减少氢离子的物质的量,所以A正确。氯化钠溶液也是相当于稀释,B正确。碳酸钠能消耗氢离子,导致生成的氢气减少,C不正确,锌能置换出铜,从而构成原电池,加快反应速率,D不正确。答案选AB。
(3)根据(1)可知,在2~3内生成的氢气最多,氢气的物质的量是0.005mol,消耗盐酸是0.01mol,所以盐酸的反应速率是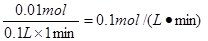 。 。
本题难度:简单
3、填空题 为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中。试回答:
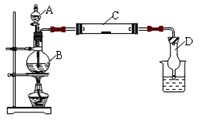
(1)怎样检验装置的气密性??????????????????????????????????????????????????????;
(2)若C中为淀粉KI试纸,实验片刻后C中可以观察到的实验现象为???????;写出
B中发生反应的离子方程式?????????????????????????????????????????????????。
(3)若C中的淀粉KI试纸实验一段时间后又变为无色,原因是??????????????????。
(4)D的作用是_______________。烧杯中加入的是??????????????????????。
(5)若实验室暂时无二氧化锰,仍用此装置制取氯气,选用???????????药品替代。若实验室暂时无浓盐酸,仍用此装置制取氯气,选用??????????????????药品替代。
参考答案:(12分)(1)关闭分液漏斗,对烧瓶进行微热,看烧杯中是否有
本题解析:略
本题难度:一般
4、实验题 (8分)某化学小组设计实验验证温度对化学反应速率的影响。
【实验用品】 溶液、 溶液、 、烧杯、冷水、热水、秒表等 、烧杯、冷水、热水、秒表等
【实验步骤】
I.取两支试管各加入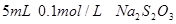 。 。
II. 另取两支试管各加入 。 。
III. ……
IV. 一段时间后,分别混合并搅拌。
V. 记录实验现象及数据。
(1)步骤III的操作为?????????。
(2)该实验需要记录的实验数据是?????????。
(3)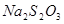 和 和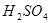 反应的化学方程式为????????????。 反应的化学方程式为????????????。
(4)能说明温度升高反应速率增大的现象是??????????。
参考答案:(8分)(每空2分)
(1)将四支试管分成两组(各有一
本题解析:(1)要验证温度对反应速率的影响,则需要进行对比实验,因此步骤Ⅲ是将四支试管分成两组(各有一支盛有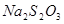 和 和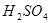 的试管),一组放入冷水中,另一组放入热水中。 的试管),一组放入冷水中,另一组放入热水中。
(2)由于反应中会产生单质硫沉淀,所以需要记录的实验数据是溶液出现混浊的时间。
(3)在酸性溶液中,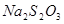 发生自身的氧化还原反应生成单质硫、SO2和水,方程式为 发生自身的氧化还原反应生成单质硫、SO2和水,方程式为 。 。
(4)温度高反应速率就快,所以出现混浊的时间就少。
本题难度:一般
5、选择题 某学生运用所学知识研究钠的性质:将一粒金属钠和一块铜片分别盛在表面皿中,来研究它们在空气中的稳定性。该学生采用的研究方法是[???? ]
①假说法 ②实验法 ③分类法 ④比较法
A.①②
B.①③
C.②④
D.①③
参考答案:C
本题解析:
本题难度:简单
|