微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各表述与示意图一致的是( )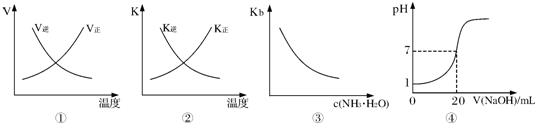
A.图①表示反应N2(g)+O2(g)?2NO(g)△H>0正、逆反应的速率随温度的变化
B.图②表示反应N2(g)+3H2(g)?2NH3(g)△H<0正、逆反应的平衡常数随温度的变化
C.图③表示氨水的电离平衡常数随氨水浓度c(NH3?H2O)的变化
D.图④表示25℃时,用0.1mol?L-1NaOH溶液滴定20mL 0.lmol?L-1盐酸,溶液的pH随加入碱体积的变化
参考答案:A、该反应为吸热反应,温度升高,正逆反应速率都增大,平衡向着
本题解析:
本题难度:一般
2、填空题 (12分)在80℃时,将0.40 mol的N2O4气体充入1 L固定容积的密闭容器中发生反应:N2O4  2NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
2NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
时间(s)
| 0
| 20
| 40
| 60
| 80
| 100
|
n(N2O4)(mol)
| 0.40
| a
| 0.20
| c
| d
| e
|
n(NO2)(mol)
| 0.00
| 0.24
| b
| 0.52
| 0.60
| 0.60
(1)在20s — 40s之间,用N2O4表示的平均反应速率为 。
(2)在80℃时该反应的平衡常数K= 。
(3)要增大该反应的平衡常数,可采取的措施有(填序号) 。
①增大N2O4的起始浓度 ②向混合气体中通入NO2
③使用高效催化剂 ④升高温度
(4)反应进行至100s后若降低温度,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(5)反应进行至100s后若向容器中再充入0.40 mol的N2O4气体,则达到新平 衡后N2O4的转化率将 (填“增大”、“减小”或“不变”)。 衡后N2O4的转化率将 (填“增大”、“减小”或“不变”)。
参考答案:(12分))(1)0.004 mol·L-1·s-1(3分)
本题解析:略
本题难度:一般
3、选择题 下列各组实验中,过氧化氢分解最快的是( )
| H2O2的浓度(质量分数) | 温度(℃) | 催化剂的使用
A
2
10
使用MnO2
B
4
10
不使用
C
6
30
使用MnO2
D
6
30
不使用
A.A
B.B
C.C
D.D
参考答案:浓度越大,温度越高,反应速率越快,使用催化剂加快反应.
本题解析:
本题难度:简单
4、简答题 铁及其化合物在生活中应用广泛.请回答下列问题:
(1)下列4组等质量的铁与过量的盐酸在不同条件下反应,反应速率最快的是______;
| 组别 | c(HCl)(mol/L) | 温度(℃) | 状态
A
2.0
30
块状
B
2.5
30
块状
C
2.0
50
粉末状
D
2.5
50
粉末状
(2)生活中的磁铁的主要成分是______;(填化学式)
(3)可以通过______效应来鉴别FeCl3溶液和Fe(OH)3胶体;
(4)为了检验某FeCl2溶液是否变质,可向溶液中加入______.
A.NaOH溶液B.KSCN溶液C.石蕊试液.
参考答案:(1)一般来说,反应物浓度越大,温度越高,固体表面积越大,则
本题解析:
本题难度:一般
5、填空题 (14分)将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)  2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示: 2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
HI体积分数
| 1min
| 2min
| 3min
| 4min
| 5min
| 6min
| 7min
| 条件I
| 26%
| 42%
| 52%
| 57%
| 60%
| 60%
| 60%
| 条件II
| 20%
| 33%
| 43%
| 52%
| 57%
| 65%
| 65%
(1)在条件I到达平衡时,计算该反应的平衡常数K,要求列出计算过程。
(2)在条件I从开始反应到到达平衡时,H2的反应速率为____________。
(3)为达到条件II的数据,对于反应体系可能改变的操作是_______________。
(4)该反应的△H_____0(填">","<"或"=")
(5)在条件I下达到平衡后,在7min时将容器体积压缩为原来的一半。请在图中画出c(HI)随时间变化的曲线。

参考答案:(1)设I2消耗浓度为x
I2(g) +&
本题解析:
试题分析:(1)根据化学平衡计算平衡时各物质的浓度,设I2消耗浓度为x
I2(g) + H2(g)  2HI(g) 2HI(g)
起始浓度(mol/L): 0.8 1.2 0
转化浓度(mol/L): x x 2x
平衡浓度(mol/L):0.8-x 1.2-x 2x
HI的体积分数为60%,则:2x/2=60%,x="0.6" mol/L,再根据平衡常数的计算公式K=c2 (HI) /[c(H2)·c(I2)]进行计算,K=1.22/(0.2×0.6)=12。(2)氢气的反应速率=0.6/5=0.12mol/(L·min)。(3)根据表格分析,相同时间内,碘化氢的体积分数变化小,说明速率慢,温度低。(4)平衡时碘化氢的体积分数大,说明降温平衡正向移动,△H<0。(5) 体积压缩到原来一半,则碘化氢的浓度变成原来2倍,平衡不移动,所以图像为:
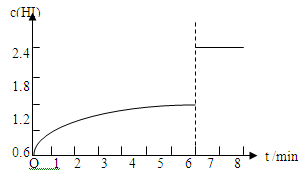
考点:化学平衡状态的计算和判定。
本题难度:困难
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|