微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)向胶体中加入少量电解质或将两种带相反电荷的胶体混合,能使胶体粒子聚集长大,形成的颗粒较大的沉淀从分散剂里析出,这个过程叫做聚沉。在Fe(OH)3胶体中,逐滴加入HI稀溶液,会产生一系列变化:
(1)先出现红褐色沉淀,原因是???????????????????????????????????????????????????。
(2)随后沉淀溶解,溶液呈黄色,该反应的离子方程式为?????????????????????????????。
(3)最后溶液颜色加深,原因是。此反应的离子方程式为??????????????????????????????。
(4)用稀盐酸代替HI稀溶液,能出现上述哪些相同的现象(填序号)
?????????????????????。
参考答案:(1)加入电解质后,使胶体聚沉
(2)Fe(OH)3+
本题解析:向Fe(OH)3胶体中加HI稀溶液,产生的一系列变化是:Fe(OH)3胶体在加入电解质后,先聚沉,然后Fe(OH)3+3H+ Fe3++3H2O,最后Fe3+与I-发生氧化还原反应。用稀盐酸代替HI稀溶液,(1)(2)现象相同,但不可能出现(3)现象,因为Fe3+不能与Cl-发生氧化还原反应。
Fe3++3H2O,最后Fe3+与I-发生氧化还原反应。用稀盐酸代替HI稀溶液,(1)(2)现象相同,但不可能出现(3)现象,因为Fe3+不能与Cl-发生氧化还原反应。
本题难度:简单
2、选择题 热水法制备Fe3O4纳米颗粒的反应为:
3Fe2++2S2O32—+O2+xOH-===Fe3O4+S4O62—+2H2O
下列说法正确的是??????????????????????????????????????????????????????????????????????????????????????????????????????????????????? ( )
A.将纳米Fe3O4分散在水中没有丁达尔现象
B.将纳米Fe3O4分散在水中Fe3O4不能透过滤纸
C.每生成1 mol Fe3O4反应转移的电子数为4 mol
D.反应物OH-的化学计量数x=2
参考答案:C
本题解析:
正确答案:C
A.不正确,将纳米Fe3O4分散在水中,分散系是胶体,有丁达尔现象
B.不正确,将纳米Fe3O4分散在水中Fe3O4能透过滤纸
C.正确,每生成1 mol Fe3O4反应转移的电子数为4 mol
D.不正确,反应物OH-的化学计量数x=4
本题难度:简单
3、选择题 用饱和的氯化铁溶液制取氢氧化铁胶体,正确的操作是
A.将饱和氯化铁溶液滴入蒸馏水中即可
B.将饱和氯化铁溶液滴入热水中,生成棕黄色液体即可
C.将饱和氯化铁溶液滴入沸水中,并继续煮沸至生成红褐色液体即可
D.将饱和氯化铁溶液滴入沸水中,并继续煮沸至生成红褐色沉淀即可
参考答案:C
本题解析:正确的操作是:将饱和氯化铁溶液滴入沸水中,并继续煮沸至生成红褐色液体即可。故选C
本题难度:简单
4、选择题 根据有关信息:2SO2(g)+O2(g)?2SO3(g)△H=-196.7kJ/mol;某种硝酸钙晶体可表示为Ca(NO3)2?8H2O;25℃时NaHCO3的溶解度为9.6g/100g水;空气中氧气的体积分数为21%,判断下列有关数据正确的是
A.室温下,可以配制2.5mol/L的NaHCO3溶液
B.爆炸最强烈的坑道气中甲烷的体积分数为10.5%
C.用1molSO2气体与足量氧气充分反应可放出98.35kJ的热量
D.用一定量质量分数为50%的硝酸与CaO作用能直接制得Ca(NO3)2?8H2O晶体
参考答案:D
本题解析:分析:A.根据25℃时NaHCO3的溶解度为9.6g/100g水求出饱和溶液中NaHCO3溶液的物质的量的浓度解答;
B.根据甲烷的爆炸方程式解答;
C.二氧化硫与氧气反应是可逆反应;
D.以CaO和HNO3为原料制备Ca(NO3)2?8H2O晶体.为确保制备过程中既不补充水分,也无多余的水分,也就是硝酸溶液中的水全部参与化学反应生成Ca(NO3)2?8H2O晶体,反应方程式为CaO+2HNO3+7H2O=Ca(NO3)2?8H2O,据此解答.
解答:A.25℃时NaHCO3的溶解度为9.6g/100g水,100克水为0.1L,溶液的体积约为0.1L,饱和溶液中NaHCO3溶液中碳酸氢钠的物质的量为: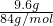 =0.11mol,则其溶液的物质的量的浓度为
=0.11mol,则其溶液的物质的量的浓度为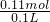 =1.1mol/L,故A错误;
=1.1mol/L,故A错误;
B.爆炸最剧烈时,根据?CH4+2O2 2H2O+CO2可知,甲烷和氧气恰好完全反应时的体积比是1:2,氧气约占空气总体积的五分之一,所以甲烷与空气相互混合时爆炸最强烈时的体积比为1:10,爆炸最强烈的坑道气中甲烷的体积分数为9.09%,故B错误;
2H2O+CO2可知,甲烷和氧气恰好完全反应时的体积比是1:2,氧气约占空气总体积的五分之一,所以甲烷与空气相互混合时爆炸最强烈时的体积比为1:10,爆炸最强烈的坑道气中甲烷的体积分数为9.09%,故B错误;
C.据2SO2(g)+O2(g)?2SO3(g)△H=-196.7kJ/mol可知SO2和O2反应生成2molSO3时放出的热量为196.7kJ,所以生成1molSO3时放出的热量为98.35kJ,由于是可逆反应,1mol?SO2和0.5molO2不能完全反应,所以放出的热量小于98.35kJ,故C错误;
D.工业上以CaO和HNO3为原料制备Ca(NO3)2?8H2O晶体.为确保制备过程中既不补充水分,也无多余的水分,也就是硝酸溶液中的水全部参与化学反应生成Ca(NO3)2?4H2O晶体,反应方程式为CaO+2HNO3+7H2O=Ca(NO3)2?8H2O.
令硝酸的质量为126g,则:CaO+2HNO3+7H2O=Ca(NO3)2?8H2O
??????????????????????????? 126g??126g
因此硝酸溶液中溶质的质量分数是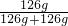 ×100%=50%,故D正确;
×100%=50%,故D正确;
故选D.
点评:本题主要考查了有关计算,理解饱和溶液的概念,制备Ca(NO3)2?8H2O晶体、可逆反应等是解答的关键,题目难度中等.
本题难度:困难
5、选择题 下列说法正确的是
A.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
B.使用催化剂可以改变化学反应的反应热
C.将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为氢氧化钠
D.反应2CO(g)=2C(s) + O2(g) H>0可以自发进行
H>0可以自发进行
参考答案:A
本题解析:A 正确。
B 错误,使用催化剂只改变化学反应速率,不能改变化学反应的反应热
C 错误,所得固体的成分均为碳酸钠
D 错误,此反应 H>0,
H>0,
本题难度:一般