| -->
1、选择题 实验室用98%的浓硫酸(密度为1.84g/mL)配制0.5mo1/L硫酸溶液500mL,不需要使用的仪器是( )
A.500?mL容量瓶
B.25?mL量筒
C.烧杯
D.天平
参考答案:D
本题解析:
本题难度:简单
2、实验题 某同学帮助水质检测站配制480 mL 0.5 mol/L NaOH溶液以备使用。
(1)该同学应选择____ mL的容量瓶。
(2)其操作步骤如图所示,则图中操作应在下图中的____(填选项字母)之间。
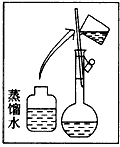

A.②与③ B.①与② C.④与⑤
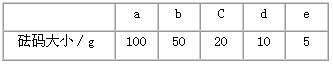
(3)该同学应称取NaOH固体_____g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小____(填字母),并在下图中选出能正确表示游码位置的选项____(填字母)。
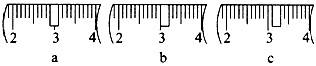
(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________(填“偏大”、“偏小”或“无影响”,下同)
②容量瓶中原来有少量蒸馏水,浓度会_______。
参考答案:(1)500
(2)C
(3)10.0;cd
本题解析:
本题难度:一般
3、选择题 配制一定物质的量浓度的Na2CO3溶液,下列操作正确的是[???? ]
A.称量时,将Na2CO3固体直接放在托盘天平的右盘上
B.将Na2CO3固体在烧杯中溶解,所得溶液冷却到室温,再转移至容量瓶中
C.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
参考答案:B
本题解析:
本题难度:简单
4、实验题 实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。

(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
C.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为____________ g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_________ 0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为__________ mL(保留1位小数),如果实验室有15mL、20mL、50mL量筒,应选用__________ mL量筒最好。
(5)配制硫酸溶液过程中,下列操作会引起结果偏高的是____________ (填序号)
①未洗涤烧杯、玻璃棒
②未冷却至室温就转移到容量瓶定容
③容量瓶不干燥,含有少量蒸馏水
参考答案:(1)B、D;玻璃棒、500mL容量瓶;
(2)B、C
本题解析:
本题难度:一般
5、简答题 通常在医院给病人输液用的生理盐水是质量分数为0.9%的氯化钠溶液,假设它的密度为1.1g?cm-3,则:
(1)该氯化钠溶液的物质的量浓度为______mol?L-1.
(2)若用NaCl固体配制1000mL该溶液,下列仪器中,肯定不会用到的是______
A.锥形瓶B.容量瓶C.漏斗D.玻璃棒E.托盘天平F.试剂瓶
(3)下列操作的顺序是(用字母表示)______
A.冷却B.称量C.定容D.溶解E.转移
(4)若要实施配制,除上述仪器外,还缺少的仪器是______、______.
(5)本实验中几个操作中都要用到玻璃棒,使用玻璃棒的作用是______、______.
(6)配制完毕后,教师指出有5位同学各进行了下列某一项错误操作,你认为这5项错误操作会导致所得溶液浓度偏低的是______
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解而未冷却的溶液直接转入容量瓶
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
E.称量时,砝码和药品的位置放错了.
参考答案:(1)1L氯化钠溶液中氯化钠的质量是:1000mL×1.1g
本题解析:
本题难度:一般
|