微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。
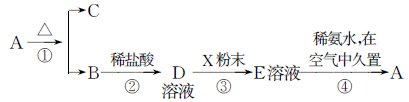
(1)写出下列物质的化学式:
A:__________,B:__________,D:__________,E:__________,X:__________。
(2)写出反应①的化学方程式:________________________________。
写出反应③的离子方程式: ________________________________。
写出反应④过程中,白色沉淀在空气中久置的化学方程式:________________。
参考答案:(1)A: Fe(OH)3? B:Fe2O3 ??D:FeC
本题解析:
试题分析:由图示结合“E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色”。确定A: Fe(OH)3? B:Fe2O3 ??D:FeCl3 ??E :FeCl2?? X : Fe,进而解题。
本题难度:一般
2、实验题 某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下。
提出猜想
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜也有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
实验探究
Ⅰ. 解决问题1
(1)需用到的药品除1 mol·L-1CuSO4溶液、稀硫酸外还需????(填试剂的化学式)溶液。
(2)用胆矾晶体配制1 mol·L-1CuSO4溶液250 mL,选用的仪器除烧杯、托盘天平、药匙、玻璃棒、胶头滴管外,还有?????(填仪器名称)。
(3)为达到实验目的,你认为应进行哪些相关实验?
实验内容和步骤:①??????????????????;②????????????????。
Ⅱ. 解决问题2
取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答问题。
(1)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:??????????????,
(2)从实验Ⅱ可得出的结论是??????????????????????????????。
Ⅲ. 解决问题3
设计如下装置(夹持装置未画出):

当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01 mol X,测得B装置增重0.36 g,并收集到0.28 g单质气体Y。
(1)X气体的摩尔质量是?????。
(2)C中发生反应的化学方程式为?????????????????????????????。
参考答案:Ⅰ(1)NaOH溶液(1分 )
(2)250mL容量瓶
本题解析:
试题分析:Ⅰ(1)探究氢氧化铜是否能和硫酸和氢氧化钠反应的实验需要的药品是:制取氢氧化铜的硫酸铜和氢氧化钠,验证试验用到硫酸和氢氧化钠,所以需要硫酸铜和氢氧化钠以及硫酸溶液。(2)配制一定物质的量浓度的溶液所需仪器:烧杯、天平、玻璃棒、量筒、胶头滴管、一定体积的容量瓶,容量瓶的规格根据所配置的溶液来确定,故答案为:250mL容量瓶;(3)氢氧化铜是否能和硫酸和氢氧化钠反应的实验中,首先是氢氧化铜的配制,然后是让氢氧化铜和硫酸以及氢氧化钠反应,所以实验步骤第一步是:用CuSO4溶液和NaOH溶液制C
本题难度:一般
3、填空题 (15分)铁和铁的化合物在工业生产和日常生活中都有广泛的用途,请回答下列问题:
(1)铁元素在周期表中的位置是????????????。
(2)写出Fe与稀硫酸反应的离子方程式????????????。
(3)已知:Fe2O3(s)+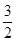 C(s)=
C(s)=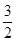 CO2(g)+2Fe(s);△H=+234.1kJ/mol
CO2(g)+2Fe(s);△H=+234.1kJ/mol
C(s)+O2(g)=CO2(g); △H=-393.5kJ/mol.
请写出Fe(s)与O2(g)反应生成Fe2O3(s)的热化学方程式???????????。
(4)在一定条件下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g);工业上有16 t Fe2O3在200m3的容器中反应,l小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为???????????mol/(L·h).
2Fe(s)+3CO2(g);工业上有16 t Fe2O3在200m3的容器中反应,l小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为???????????mol/(L·h).
(5)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2;高铁酸钠( Na2FeO4)是一种新型饮水消毒剂.用题29图装置可以制取少量高铁酸钠.
Fe(OH)2+Ni(OH)2;高铁酸钠( Na2FeO4)是一种新型饮水消毒剂.用题29图装置可以制取少量高铁酸钠.
①此装置中爱迪生蓄电池的负极是____(填“a”或"b”).
②写出阳极的电极反应式________.
③当制得132.8g高铁酸钠时,阳极区减少的阴离子的物质的量为????????????.
参考答案:(1)第四周期,Ⅷ族(2分)
(2)Fe+2H+= F
本题解析:(1)铁的原子序数是26,位于第四周期,Ⅷ族。
(2)铁和稀硫酸反应生成硫酸亚铁和氢气,方程式为Fe+2H+= Fe2++H2↑。
(3)考查盖斯定律的应用。根据已知反应可知②×2/3-①即得到2Fe(s)+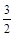 O2(g) = Fe2O3(s) ,所以反应热是-393.5kJ/mol×3/2-234.1
O2(g) = Fe2O3(s) ,所以反应热是-393.5kJ/mol×3/2-234.1
本题难度:一般
4、选择题 下列陈述和判断均正确,且有因果关系的是(????? )
选项
| 陈述
| 判断
|
A
| Si有良好的半导体性能
| Si可用于制备光导纤维
|
B
| 在未知溶液中加入稀硝酸和氯化钡溶液有沉淀生成
| 说明该未知溶液含有SO42-
|
C
| 铁、铜、汞、银的金属活动性顺序为Fe>(H)>Cu>Hg>Ag
| 要从矿石中冶炼得到金属单质,铁和铜必须用还原剂,汞和银只需加热
|
D
| 锌锰干电池碳棒是正极,MnO2是氧化剂
| 锌锰干电池是二次电池,可以反复充电
参考答案:C
本题解析:
试题分析:单质硅是很好的半导体材料,但是制备光导纤维的是其氧化物二氧化硅,A错误;用氧化性强的硝酸酸化氯化钡溶液,不能排除SO32- 的干扰,因此B判断错误;C中陈述I陈述的金属的活动性顺序正确,由于金属活动性越强,越难制备得到,因此结合实际金属的制备情况,从陈述I可以找到与陈述II之间的因果关系,C正确;锌锰干电池是普通的一次电池,D陈述错误;故选C。
本题难度:简单
5、选择题 将过氧化钠投入FeCl2溶液中,可观察到的实验现象是( ) A.有无色气体产生
B.没有沉淀生成
C.有白色沉淀生成
D.无红褐色沉淀生成
参考答案:A
本题解析:
本题难度:简单
|