微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知H2A是一种无机二元酸,请回答以下问题:
(1) 若H2A为二元弱酸,在水溶液中的电离方程式为 ;
(2) 若NaHA溶液显碱性,则H2A是 (填“强酸”、“弱酸”或“无法确定”),原因是 。
(3) 若溶液显酸性,在25℃下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是 ;
a.c(H+)·c(OH-)=1×10-14 b.c(Na+)+c(K+)=0.1 mol·L-1
c.c(Na+)>c(K+) d.c(Na+)=c(HA-)+c(A2-)
参考答案:
(1)H2A 本题解析:
本题解析:
试题分析:(1)多元弱酸部分电离,分步书写。(2)若NaHA溶液显碱性, 说明HA-水解生成H2A和OH-使溶液显碱性,故H2A必为弱酸;(3)在25℃下,任何溶液一定存在c(H+)·c(OH-)=1×10-14,故a正确;滴加到溶液刚好反应时,生成Na2A和K2A,溶液呈碱性,要成中性必须NaHA过量,故b错、C错;根据物料守恒:c(Na+)=c(HA-)+c(A2-)+ c(H2A),故d错。
考点:考查弱电解质的电离、盐类水解、水溶液中的离子平衡等相关知识。
本题难度:一般
2、选择题 下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol/L CH3COOH溶液中:c(CH3COO-)+ c(CH3COOH)=0.1mol/L
B.NaHCO3溶液中:c(OH-) = c(H+) + c(H2CO3)-c(CO32—)
C.CH3COONa溶液中:c(Na+)> c(CH3COO-)> c(OH-)> c(H+)
D.Na2S溶液中:2 c(Na+)= c(S2—) + c(HS—)+ c(H2S)
参考答案:D
本题解析:A项,考查物料守恒,CH3COOH部分电离产生CH3COO-和H+,醋酸根原子团守恒,得c(CH3COO-)+ c(CH3COOH)=0.1mol/L。B项,根据电荷守恒关系式C(Na+)+ c(H+)= 2 c(CO32—)+ c(HCO3—)+ c(OH-)和物料守恒关系式c(Na+)= c(CO32—)+ c(HCO3—)+ c(H2CO3),可计算得到c(OH-) = c(H+) + c(H2CO3)-c(CO32—)。C项,CH3COO-水解显碱性,所以c(Na+)> c(CH3COO-),c(OH-)> c(H+)。因为OH-是水解产生的,量很小,所以c(OH-)> c(H+)排在后边。D项,考查的物料守恒,c(Na+)=2 c(S)=2(c(S2—) + c(HS—)+ c(H2S))
本题难度:困难
3、选择题 向20 mL 0.1 mol·L-1氨水中逐滴加入0.1mol·L-1稀HCl,混合液pH与所加盐酸体积(V/mL)的关系如图所示。下列说法正确的是
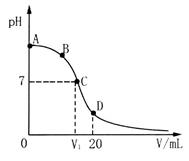
A.在D点:c(NH4+)+c(NH3·H2O)>c(Cl-)
B.在C点,有V1>10,且c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C.在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.由B到C的过程中,c(NH4+)/c(NH3·H2O)先增大后减小
参考答案:B
本题解析:
试题分析:A、在D点,对应20mL的稀盐酸与氨水恰好完全反应,溶质只有NH4Cl,根据物料守恒c(NH4+)+c(NH3·H2O)=c(Cl-),错误;B、恰好完全反应时,溶质是NH4Cl,其属于强酸弱碱盐,水溶液显酸性,V1=10mL,此时溶液中溶质是NH4Cl、NH3·H2O,NH3·H2O的电离大于NH4+的水解溶液显碱性,因此pH=7,V1>10,根据溶液呈现电中性,c(NH4+)+c(H+)=c(Cl-)+c(OH-),pH=7则c(OH-)=c(H+),有c(NH4+)=c(Cl-),c(NH4+)=c(Cl-)>c(OH-)=c(H+),正确;C、在A、C间任一点,有可能只加入很少量的稀盐酸,此时溶液中离子浓度:c(NH4+)>c(OH-)>c(Cl-)>c(H+),错误;D、由B到C的过程中,不断生成NH4+,NH3·H2O不断消耗,因此c(NH4+)/c(NH3·H2O)一直增大,错误。
考点:考查离子浓度大小的比较、物料守恒、电荷守恒等相关知识。
本题难度:困难
4、填空题 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性。某兴趣小组用如图所示装置进行Mg与SO2反应的实验。
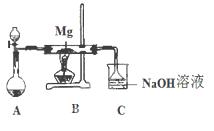
(1)选择制取SO2的合适试剂 (填编号)。
①浓HCl ②浓H2SO4
③Na2SO3固体 ④CaSO3固体
(2)上述装置还可优化,优化的方法是 ,实验后装置C中所得溶液离子浓度关系一定正确的是(选填字母)
A.(Na+)= 2c(SO32-)+ c(HSO3-),
B.(Na+)> c(HSO3-)> c(SO32-)> c(H+)> c(OH-),
C.(H2SO3)+ c(H+)= c(SO32-)+ (OH-),
D.(Na+)+ c(H+)=" 2" c(SO32-)+ c(HSO3-)+ c(OH-)
(3)甲同学推测Mg与SO2的反应与CO2相似,则该反应方程式为
乙同学的推测是:2Mg+3SO2 2MgSO3+S;
2MgSO3+S;
丙同学的推测是:3Mg+SO2 2MgO+MgS,
2MgO+MgS,
要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/LNaOH、品红溶液、澄清石灰水、2mol/LCuSO4;仪器和用品自选。请填写下表中的空格:
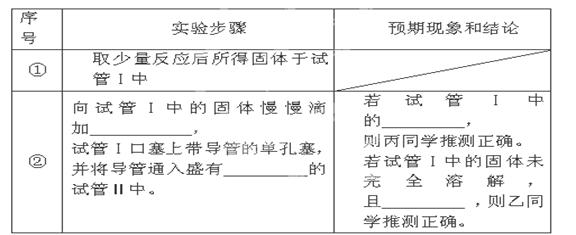
根据上述实验探究,能证明甲同学推测正确的操作和预期现象是_________________ _
(4)上述实验需要50mL,2mol/L的HCl,配制时应选用 (10 mL ,25 mL ,,50 mL或100 mL)量筒量取36.5%,密度1.19g/mL的浓盐酸的体积。
参考答案:(1)②③(2分)
(2)在A和B之间增加用浓硫酸干燥
本题解析:
试题分析:(1)因SO2的溶解度较大,应选用浓度较大的H2SO4溶液;为了使反应顺利进行须选择Na2SO3固体与硫酸反应(CaSO3固体与硫酸反应生成的硫酸钙微溶于水);
(2)SiO2、CO2都是酸性氧化物,所以镁与玻璃中的二氧化硅能发生反应,镁不能与玻璃管直接接触;又因为镁与钠的性质相似,能与水反应,因此A、B间应加干燥装置;实验后装置C中为Na2SO3溶液,A、根据物料守恒可得:(Na+)= 2c(SO32-)+2 c(HSO3-)+2c(H2SO3),错误;B、Na2SO3分两步水解,以第一步为主,可得:(Na+)> c(OH-)> c(HSO3-)> c(SO32-)> c(H+),错误;C、根据质子守恒可得:(OH-)= c(HSO3-)+ 2(H2SO3)+ c(H+),错误;D、根据电荷守恒可得:(Na+)+ c(H+)=" 2" c(SO32-)+ c(HSO3-)+ c(OH-),正确。
(3)根据Mg与CO2的反应可类比得:2Mg+SO2  2MgO+S;先加入2mol/L 盐酸至过量,可检验产物中是否含有MgS,气体通入品红可检验是否生成了MgSO3,若试管Ⅰ固体完全溶解,说明没有S,则丙同学推测正确;若试管Ⅰ固体未完全溶解且品红溶液褪色,说明产物含有MgSO3,则乙同学推测正确;因为甲同学推测生成MgO和S,所以能证明甲同学推测正确的操作和预期现象是:向反应后所得固体加过量2mol?L?1盐酸,固体未完全溶解且品红溶液不褪色。
2MgO+S;先加入2mol/L 盐酸至过量,可检验产物中是否含有MgS,气体通入品红可检验是否生成了MgSO3,若试管Ⅰ固体完全溶解,说明没有S,则丙同学推测正确;若试管Ⅰ固体未完全溶解且品红溶液褪色,说明产物含有MgSO3,则乙同学推测正确;因为甲同学推测生成MgO和S,所以能证明甲同学推测正确的操作和预期现象是:向反应后所得固体加过量2mol?L?1盐酸,固体未完全溶解且品红溶液不褪色。
(4)设需要浓盐酸的体积为V,可得:0.05L×2mol/L×36.5g/mol=V×1.19g/mL×36.5%,则V=8.4mL,所以选择10mL量筒量取。
考点:本题考查制取气体试剂的选择、反应装置的选用、离子浓度比较、反应方案的分析、浓度的计算。
本题难度:困难
5、选择题 下列各反应的化学方程式中,属于水解反应的是( ? )
A.H2O+H2O?H3O++OH-
B.HCO3-+OH-?H2O+CO32-
C.CaO+H2O=Ca(OH)2
D.HCO3-+H2O?H2CO3+OH-
参考答案:D
本题解析:
本题难度:一般