微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,
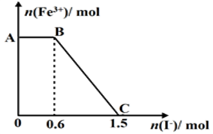
下列说法中不正确的是
A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I- =2Fe2++I2
C.开始加入的K2Cr2O7为0.25 mol
D.K2Cr2O7可与FeSO4反应的物质的量为1:3。
参考答案:D
本题解析:
试题分析:A.开始时Fe3+浓度不变,则说明Fe3+没有参加反应,则AB应为K2Cr2O7和碘化钾的反应,K2Cr2O7为氧化剂,故A正确;B.BC段Fe3+浓度逐渐减小,为铁离子和碘化钾的反应,反应的离子方程式为2Fe3++2I-=2Fe2++I2,故B正确;C.由氧化剂和还原剂得失电子数目相等可知反应的关系式为K2Cr2O7~6Fe3+~6I-,共消耗的n(I-)=1.5mol,则开始加入的K2Cr2O7的物质的量为1.5mol÷6=0.25mol,故C正确;D.由方程式2Fe3++2I-=2Fe2++I2可知,BC段消耗KI0.9mol,则n(Fe3+)=n(Fe2+)=0.9mol,K2Cr2O7可与FeSO4反应的物质的量为0.25mol:0.9mol=5:18,故D错误,故选D。
考点:考查氧化还原反应的应用与计算
本题难度:一般
2、选择题 某反应体系中存在下列六种物质:As2S3、HNO3、H2SO4、NO、H3AsO4和H2O,已知其中As2S3是反应物之一。下列说法不正确的是
A.该反应属于氧化还原反应
B.此反应中只有砷元素被氧化,只有氮元素被还原
C.HNO3、H2O是反应物,H2SO4、NO、H3AsO4是生成物
D.HNO3、H2SO4、H3AsO4都是最高价氧化物对应的水化物
参考答案:B
本题解析:
试题分析:根据“As2S3是反应物之一”,说明是H3AsO4、H2SO4生成物,反应前后As、S元素的化合价升高,进一步说明“HNO3是反应物,NO是生成物(反应前后N元素的化合价降低)”,从而判断B项错误。
考点:考查氧化还原反应原理。
本题难度:一般
3、选择题 假定把12C的相对原子质量定为24,把24g12C含有的原子个数定为阿伏加德罗常数,而物质的量的概念不变。则下列推断不正确的是…………
A.此时16O的相对原子质量为32
B.标况下44g CO2的体积为22.4L
C.NA个氧分子与NA个氢分子有相同数目的分子
D.44g CO2和28g CO含有相同数目的分子
E.标况下,1mol O2为44.8L
F.40g NaOH溶于水配成1L溶液,其物质的量浓度为1mol·L-1
参考答案:F
本题解析::本题考查的知识点是:对物质的量、相对原子质量、阿伏加德罗常数、摩尔质量、气体摩尔体积、质量、体积等一系列概念的理解。解答本题时可将一系列物理量分为两大类,即客观的,如质量、体积、微粒数、密度等,它们不随人为规定而改变;另一类为主观的,如物质的量、阿伏加德罗常数、气体摩尔体积、摩尔质量、原子量、分子量等均为人为规定,它们随人为规定的改变而改变。而且原子量的标准改变会使原子量和分子量的数值改变,而阿伏加德罗常数标准的改变会引起物质的量、摩尔质量、气体摩尔体积、物质的量浓度及阿伏加德罗常数的数值发生改变。
----本题中原子量的标准的改变实际上是将原子量的标准由12C原子质量的1/12变为12C原子质量的1/24。所以将12C的原子量定为24时,物质的式量加倍。而将阿伏加德罗常数由12g12C所含碳原子数变为24g12C所含原子个数。所以摩尔质量、气体摩尔体积都应加倍,而物质的量及物质的量浓度均随之发生变化。
----具体分析如下:
A、正确,氧原子的实际质量没变,但标准却由12C质量的1/12变为1/24,所以16O的原子量由16变为32
B、正确,44gCO2客观存在,其标况下的体积22.4L也客观存在
C、正确,此时NA虽然由原来的约6.02×1023变为约12.04×1023,但对氧分子和氢分子而言,这种变化是一致的
D、正确,理由同C
E、正确,虽然氧气的体积是客观存在的,32g的体积就是22.4L,64g的体积就是44.8L,但此时32g和64g谁是1mol呢?务必注意到“标准”的改变,显然此时的64g氧气才是1mol,体积44.8L
F、不正确,由于“标准”的改变,此时的40gNaOH已经不是1mol了, 而是0.5mol!!则,所得溶液的物质的量浓度为0.5mol·L-1
本题难度:一般
4、选择题 下列氧化还原反应的方程式配平正确的是
A.Fe3++ S2-====Fe2++S
B.Fe3++Fe====2 Fe2+
C.Fe2++Cl2====Fe3++2 Cl-
D.2 Fe3++2I-====2 Fe2++I2
参考答案:D
本题解析:A、B、C电荷不守恒。
本题难度:一般
5、选择题 在下列反应中, HCl 作氧化剂的是( )
A.NaOH+HCl=NaCl+H2O
B.Zn+2HCl=ZnCl2+H2↑
C.MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.CuO+2HCl=CuCl2+H2O
参考答案:B
本题解析:
试题分析:物质所含元素化合价降低的,即得到电子的物质是氧化剂。所以选项B正确,A和D不是氧化还原反应,C中氯化氢被氧化,作还原剂,答案选B。
考点:考查氧化还原反应的有关判断
本题难度:一般