微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 在50mL a mol·L-1的硝酸溶液中,加入6.4g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100mL时测得c(NO3-)="3" mol·L-1。
(1)求稀释后的溶液的pH?????????。
(2)若生成的气体中NO2的物质的量为0.125 mol,则a=???????????
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH→2NaNO2+H2O?????? 2NO2+2NaOH→NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入2mol·L-1的NaOH恰好被吸收,求NaOH溶液的体积为??????mL。生成的NaNO2为???????????mol。
(4)治理氮氧化物污染的另一种方法,可用氨氧混合气进行选择性催化还原处理。其主要反应原理如下:
4NO + 4NH3 + O2 4N2 + 6H2O?? 6NO2 + 8NH3
4N2 + 6H2O?? 6NO2 + 8NH3 7N2 + 12H2O
7N2 + 12H2O
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
①氨氧混合气的平均相对分子质量为???????????(精确到0.01)。
②要处理5m3的尾气,需要氨氧混合气的体积为????????????L。
参考答案:(1)0 ?(2分)
(2)a=?? 9 ??(2分)
本题解析:
试题分析:(1)6.4g?Cu的物质的量为6.4/64=0.1mol,所以溶液n(Cu2+)=n(Cu)=0.1mol,溶液中c(NO3-)=c(H+)+2c(Cu2+),所以溶液中c(H+)=2c(Cu2+)-c(NO3-)=0.1/0.05×2-3mol/L=1mol/L,所以入PH=-lg1=0,故答案为:0.
(2)根据N元素守恒,可知n(NO2)+n(NO)=n硝酸溶液(HNO3)-n反应后溶液(NO3-)=0.05amol-0.1L×3mol/L=0.125mol+n(NO),根
本题难度:一般
2、选择题 在KCl、FeCl3、Fe2(SO4)3三种盐配成的混合溶液中,若K+为0.15 mol,Fe3+为0.25 mol,Cl-为0.2 mol,则SO42-为(? )
A.0.1 mol
B.0.15 mol
C.0.25 mol
D.0.35 mol
参考答案:D
本题解析:
试题分析:
KCl中K+为0.15 mol,Cl-为0.15 mol;Cl-的总量是为0.2 mol,所以FeCl3中Cl-为0.05 mol,Fe3+为0.05/3 mol,Fe3+的总量是为0.25 mol,所以Fe2(SO4)3中Fe3+为0.25-0.05/3 mol,所以SO42-为0.35 mol,故选D。
点评:对于给定的物质,化学式确定,那么原子之间的比例关系就唯一确定。
本题难度:一般
3、选择题 15g A物质和10.5g B物质完全反应,生成7.2g C物质,1.8g D物质和0.3mol E物质,则E的摩尔质量为
A.16.5 g·mol-1
B.85 g·mol-1
C.55
D.55 g·mol-1
参考答案:D
本题解析:根据质量守恒定律可知,E物质的质量是15g+10.5g-7.2g-1.8g=16.5g,所以根据M=m/n可知,E物质的摩尔质量是16.5g÷0.3mol=55g/mol,答案选D。
本题难度:一般
4、选择题 质量为1g的H2O中含m个氢原子,则阿伏加德罗常数的数值为( )
A.m/9
B.9m
C.2m
D.m
参考答案:B
本题解析:1g水的物质的量是1/18mol,水是2个原子和1各氧原子构成的分子,所以氢原子的物质的量是1/9mol。由于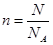 ,所以阿伏加德罗常数为9m mol-1,选项B正确,答案选B。
,所以阿伏加德罗常数为9m mol-1,选项B正确,答案选B。
本题难度:一般
5、填空题 有m克某气体,它由双原子分子构成,它的摩尔质量为M克/摩尔。若阿伏加德罗常数用NA表示,则:该气体所含原子总数为???????个, 该气体溶于V升水中(不考虑与水反应,水的密度为1 g/cm3),则溶液的质量分数为?????????;该气体溶于水后形成溶液的密度为d g/cm3,其溶液的物质的量浓度为????????。
参考答案:.2mNA/M????? 100m/(m+100V)%???
本题解析:略
本题难度:一般