微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质中只含游离态氯元素的是
A.液氯
B.氯水
C.盐酸
D.次氯酸
参考答案:A
本题解析:液氯中只有氯分子;氯水中有H2O、Cl2、HClO、H+、Cl-、ClO-、OH-;盐酸中有H2O、H+、OH-、Cl-;次氯酸为HClO,其中含有H2O、HClO、H+、ClO-、Cl-、OH-.故只有A中只含游离态氯元素.
本题难度:一般
2、选择题 某浓H2SO4的标签上写明含H2SO4?96~98.3%,欲得其准确的值,有效的方法是
①.测pH值?? ?②.测导电性大小?? ? ③.测密度???? ④.进行中和滴定.
A.①②③④
B.①②③
C.①③④
D.③④
参考答案:D
本题解析:分析:要获得浓硫酸质量分数的准确的值,根据质量分数=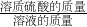 ×100%可知,需要获得一定体积浓硫酸溶液的质量与溶质的质量,据此结合选项解答.
×100%可知,需要获得一定体积浓硫酸溶液的质量与溶质的质量,据此结合选项解答.
解答:①.测pH值,只能获得溶液中氢离子的浓度,浓硫酸中硫酸主要以分子形式存在,不能确定硫酸的物质的量浓度,
②.测导电性大小,只能获得溶液中离子的浓度,浓硫酸中硫酸主要以分子形式存在,不能确定硫酸的物质的量浓度,
③.测密度,可以得到一定体积浓硫酸的质量,
④.进行中和滴定,可以确定一定体积浓硫酸中硫酸的物质的量浓度,进而确定硫酸的质量,
故通过测定密度、进行中和滴定可以确定该浓硫酸的质量分数,
故选D.
点评:本题以浓硫酸质量分数的测定为载体,考查学生对质量分数的理解、实验方案的设计能力等,难度中等,注意浓硫酸中硫酸主要以分子形式存在.
本题难度:困难
3、选择题 某饱和一元醇和饱和一元醛的混合物共3 g,与足量的银氨溶液反应后还原出16.2 g银,下列说法正确的是
A.一定有甲醛
B.可能是乙醛
C.混合物中醇、醛质量比为1∶3
D.不可能有此种醛
参考答案:A
本题解析:
本题难度:简单
4、选择题 足量的氯气或盐酸分别跟下列金属反应,均有MCl2型化合物生成的是
A.Al
B.Mg
C.Fe
D.Na
参考答案:B
本题解析:变价金属铁与氯气生成高价铁,与盐酸反应生成低价铁,不符合;只有二价金属镁符合.
本题难度:简单
5、选择题 下列电解质溶液的有关叙述正确的是
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH >7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.2000 mol/L NaOH标准溶液滴定HCI与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水②0.1mol/L盐酸③0.1 mol/L氯化镁溶液④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③
参考答案:C
本题解析:试题分析:A、醋酸是弱电解质,加水稀释过程中醋酸电离平衡正向移动,产生更多氢离子,所以稀释后溶液的pH<4,错误;B、NaHA溶液中.若pH >7,则是水解产生的,能得出H2A是弱酸;若pH<7,则可能存在单独的HA-电离,也可能是HA-电离平衡强于水解平衡,故不能判断H2A是强酸还是弱酸,错误;C、若溶液完全反应,生成CH3COONa,溶液为碱性,溶液为中性说明还有酸剩余,即溶液中的酸未被完全中和,正确;D、溶液中Cl-、Ag+抑制氯化银溶解平衡,但④中含有大量Ag+,所以Ag+浓度为④>①>②>③,错误。
考点:考查电解质溶液中电离平衡、水解平衡、沉淀溶解平衡等有关问题。
本题难度:简单