22.9
(1)试绘出溶液的温度与加入盐酸的体积之间的变化关系曲线。
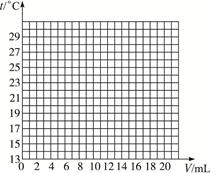
(2)根据曲线讨论溶液温度变化的原因。
①加入盐酸的量在2—10 mL之间时:_____________________________________________;
②加入盐酸的量在10—20 mL之间时:____________________________________________。
(3)若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么?
答:__________________________________________________________________________。
参考答案:(1)
 本题解析:用描点法将表格中的数据在图上表示出来,再连接成曲线。根据图象发现盐酸的量在2—10 mL时,随盐酸量增加,中和反应放出热量增大,溶液温度上升;当盐酸的量在10—20 mL之间,可能是盐酸已经过量,过量盐酸起冷却降温作用。不能用氢氧化钠固体,因为它在溶解过程中也会放热。 本题解析:用描点法将表格中的数据在图上表示出来,再连接成曲线。根据图象发现盐酸的量在2—10 mL时,随盐酸量增加,中和反应放出热量增大,溶液温度上升;当盐酸的量在10—20 mL之间,可能是盐酸已经过量,过量盐酸起冷却降温作用。不能用氢氧化钠固体,因为它在溶解过程中也会放热。
本题难度:简单
2、选择题 pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积比是
A.11∶1
B.9∶1
C.1∶11
D.1∶9
参考答案:D
本题解析:考查pH的计算。根据题意,碱是过量的,反应后溶液中c(OH-)=0.001mol/L,所以有 ,解得 ,解得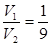 ,答案选D。 ,答案选D。
本题难度:一般
3、选择题 17.1%的蔗糖溶液200g,加适量的水稀释到5L,求稀释后的蔗糖溶液的物质的量浓度(蔗糖相对分子质量为342)??????????????????????????
A.0.2 mol·L-1
B.0.3 mol·L-1
C.0.02 mol·L-1
D.0.1 mol·L-1
参考答案:C
本题解析:略
本题难度:简单
4、选择题 物质的量浓度相同的三种盐NaX、NaY、NaZ溶液,其pH依次为7、8、9。下列有关说法正确的是(???)
A.HX、HY、HZ三种酸的酸性由强到弱的顺序为HZ>H Y>HX
B.HX是强酸,HY、HZ是弱酸,且HY的酸性强于HZ
C.X-、Y-、Z-三种酸根离子均能水解,且水解程度Z->Y->X-
D.三种盐溶液中X-、Y-、Z-的浓度大小顺序为c(X-)>c(Y-)>c(Z-)
参考答案:BD
本题解析:
试题分析:物质的量浓度相同的三种盐NaX、NaY、NaZ溶液,其pH依次为7、8、9,根据无弱不水解,有弱就水解,越弱越水解的原则,可以知道HX、HY、HZ三种酸的酸性由强到弱的顺序为HX>HY>HZ,故A错误;NaX的pH为7,所以HX是强酸,HY、HZ是弱酸,所以B正确;X-不能水解,所以C错误;水解程度为Z->Y-,而X-不能水解,所以三种盐溶液中X-、Y-、Z-的浓度大小顺序为c(X-)>c(Y-)>c(Z-),故D正确,所以本题的答案选择BD。
点评:本题考查了盐类的水解,该考点是
本题难度:简单
5、选择题 (10分) 某温度(t℃)时,测得0.01 mol/L的NaOH溶液的pH为11,则该温度下水的Kw=________,该温度________25℃(填“大于”“小于”或“等于”),其理由是________________________________________________________________________
________________________________________________________________________.
此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,通过计算填写以下不同情况时两溶液的体积比:
(1) 若所得溶液为中性,且a=12,b=2,则Va∶Vb=____________;
(2) 若所得溶液为中性,且a+b=12,则Va∶Vb=________;
(3) 若所得溶液的pH=10,且a=12,b=2,则Va∶Vb=______________.
参考答案:10-13(1分)大于(1分) 水的电离是吸热的,升温时水的
本题解析:由题意可知, 0.01mol/L的NaOH中[OH]=0.01mol/L。而此状态下,溶液pH=11,也就是说[H]=1×10-11mol/L。所以,此状态下水的Kw=[H] ×[OH]=1×10-13mol/L。该温度大于25℃,理由是水的电离是吸热的,升温时水的电离平衡向右移动,KW增大,因该温度下的KW大于25℃时水的KW,所以该温度大于25℃。
(1)NaOH溶液pH=12,则[H]=1×10-12,[OH]=Kw/[H]=(1×10-13)/(1×10-12)=0.1mol/L。
本题难度:简单
|