微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 电石(主要成分为CaC2,杂质为CaO和CaS)是工业制乙炔的常见原料,某研究性学习小组拟用以下两种方案测定CaC2的质量分数,试完成下列各题。
方法一:称取1.40 g样品于圆底烧瓶中,用分液漏斗加入适量的水,使样品反应完全,将产生的无色
气体经B洗气后,通过量气装置测得乙炔气体体积为标准状况下448 mL(不考虑乙炔在水中的溶解,
下同)。
(1)电石水解生成乙炔气体的化学方程式为:???????????????????????????????
(2)用两个装入适当试剂的广口瓶、两个双孔橡胶塞及导管若干,完成上述实验的装置,请在图中将其补充完整,并注明广口瓶中装入试剂的名称。

(3)对获得准确的气体体积无益的操作有????????????????(填序号)
①检查装置的气密性;
②恢复到室温后再上下调整量筒位置,使C、D两液面相平;
③在A装置胶塞上再连接一个导管,通入N2将A中C2H2全部进入到B、C中;
④读数时视线与量筒内凹液面最低点相平
(4)由以上数据可计算出样品中CaC2的质量分数为____?????。
方法二:称取l.40g样品于下图所示石英管中(夹持及加热装置省略),从a处不断缓缓通入空气,高
温灼烧石英管中的样品至反应完全,测得丙溶液的质量比反应前增重了1.80g,反应方程式为:2CaC2+
5O2=2CaO+ 4CO2。

(5)反应完成后,石英管内样品易与管壁产生腐蚀,试用化学方程式解释其原因????????????
(6)甲锥形瓶中酸性高锰酸钾溶液的作用为???????????????????????????????????????????
(7)由此方法测得的样品中CaC2的质量分数比方法一中的____??????????(填“大”、“小”或“相
等”),从实验装置的角度看,原因为??????????????????????????????????????????????。
参考答案:(1)CaC2+2H2O→Ca(OH)2+C2H2↑(2分,
本题解析:
试题分析:(1)电石与水反应生成碳化钙和乙炔,因此电石水解生成乙炔气体的化学方程式为CaC2+2H2O→Ca(OH)2+C2H2↑。
(2)由于生成的乙炔气体中含有杂质,因此需要利用硫酸铜溶液或氢氧化钠溶液除去。乙炔的密度和空气很接近,一般用排水法收集,所以正确的连接是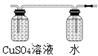 。
。
(3)①检查装置的气密性,可以防止生成的乙炔损失,因此对获得准确的气体体积有益;②恢复到室温后再上下调整量筒位置,使C、D两液面相平可以使内外压强相等,对获得准确的气体体积有益;③由于反应前装置中就存在空气,所以在A装置胶塞上再连接一个导管,通入N2将A中C2H2全部进入到B、C中对获得准确的气体体积无益;④读数时视线与量筒内凹液面最低点相平对获得准确的气体体积有益,因此答案选③。
(4)乙炔的物质的量是0.448L÷22.4L/mol=0.02mol,则根据方程式可知碳化钙的物质的量也是0.02mol,其质量=0.02mol×64g/mol=1.28g,所以碳化钙的质量分数=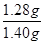 ×100%=91.43%。
×100%=91.43%。
(5)由于碳化钙生成的氧化钙是碱性氧化物,能和玻璃中的二氧化硅反应生成硅酸钙,从而腐蚀管壁,反应的化学方程式是CaO + SiO2 CaSiO3。
CaSiO3。
(6)由于电石中含有杂质元素S等,在反应中生成SO2,也能被氢氧化钠溶液吸收干扰CO2的测量,所以需要酸性高锰酸钾溶液除去CO2中混有的SO2等杂质气体。
(7)由于空气中也含有CO2,因此a处通入空气时,缺一个洗气装置,导致空气中的CO2也被丙吸收,使测量结果偏大。
本题难度:一般
2、选择题 (安徽泗县一中2008-2009学年第一学期高三第二次考试,化学,3)下列化学实验基本操作中,正确的是
A.配制溶液时,将量筒中液体倒入烧杯后,应将量筒洗涤,将洗涤液也倒入烧杯
B.稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的烧杯中并不断搅拌
C.用干燥的pH试纸分别测1 mol·L—1的NaOH溶液和1 mol·L—1的H2SO4的pH值
D.向酒精灯加酒精时,应将试剂瓶中的酒精直接倒入酒精灯中
参考答案:B
本题解析:量筒只是粗略量取液体体积的仪器,不能洗涤;pH试纸测得的值范围是1~14的整数,而通过计算1 mol·L—1的H2SO4的pH值应小于0;向酒精灯加酒精时,应用普通漏斗向酒精灯中加酒精。
本题难度:一般
3、选择题 用如图所示装置进行下列实验,能达到实验目的的是?? ( )。
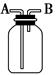
A.瓶中盛有适量浓H2SO4,从A口进气来干燥NH3
B.从B口进气,用排空气法收集CO2
C.瓶中盛满水,从B口进气,用排水法收集NO2
D.瓶中装满水,A口连接导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积
参考答案:D
本题解析:A项,不能用浓H2SO4干燥NH3;B项,用向上排空气法收集CO2时,应从A口进气;C项,NO2与H2O反应,不能用排水法收集;D项,H2难溶于水,从B口导入H2,能将瓶中水压入量筒中,从而测量H2的体积。
本题难度:一般
4、选择题 有一支50mL酸式滴定管中盛盐酸,液面恰好在a mL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是
A.a mL
B.(50―a)mL
C.大于(50―a)mL
D.大于a mL
参考答案:C
本题解析:
试题分析:滴定管的“0”刻度在上端,满刻度在下端,滴定管刻度值从上到下刻度逐渐增大,滴定管满刻度以下还有一段空间没有刻度,50mL滴定管中实际盛放液体的体积大于50mL,因此,一支50mL酸式滴定管中盛盐酸,液面恰好在a mL刻度处,把管内液体全部放出,还有满刻度以下的溶液一并放出,总量超过(50–a)mL,盛入量筒内,所得液体体积一定是大于(50–a)mL,故选C。
本题难度:简单
5、选择题 下列实验对应的结论正确的是
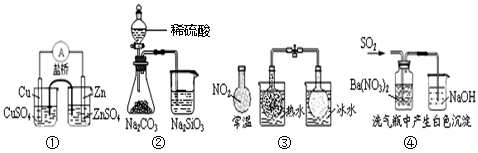
A.①能组成Zn、Cu原电池
B.②能证明非金属性:S>C>Si
C.③说明反应2NO2 N2O4△H>0
N2O4△H>0
D.④ 白色沉淀为BaSO3
参考答案:AB
本题解析:
试题分析:铜和铜盐溶液、锌和锌盐溶液、盐桥、导线组成锌铜原电池,故A项正确;滴加稀硫酸,放出气体,烧杯中生成白色沉淀,说明酸性:H2SO4>H2CO3>H2SiO3,则非金属性:S>C>Si,故B项正确;由图可知,升温平衡向生成NO2的方向移动,降温平衡向生成N2O4的方向移动,则正反应是放热反应,其△H<0,故C项错误;SO2被硝酸钡溶液氧化为SO42—,SO42—与Ba2+结合为BaSO4,故D项错误。
本题难度:一般