微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 鉴别下列各组物质的水溶液所选的试剂(括号内)中不正确的是( )
A.白酒、食醋(NaHCO3溶液)
B.葡萄糖、福尔马林[新制Cu(OH)2悬浊液]
C.食盐、纯碱(盐酸)
D.淀粉、鸡蛋清(碘水)
参考答案:A、白酒和碳酸氢钠互溶但不反应,无现象,食醋和碳酸氢钠反应生
本题解析:
本题难度:简单
2、实验题 某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡。触摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
⑴铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是______________。
A.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强???
B.硫酸铜水解生成硫酸使铝钝化
C.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能??
D.生成氯化铝溶于水,而生成硫酸铝不溶于水
请设计一个简单实验验证你的选择:__________________。?
⑵铝片表面出现的暗红色物质的过程中发生的离子反应方程式是_____________。?用离子方程式解释产生气泡的原因:_____________。
⑶放出的气体是_______________,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是_______________?。(写出一点即可)
⑷某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是___________________?。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中??
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
⑸除去氧化铝的铝片与铜片为电极,在X电解质溶液中构成原电池,列表如下:
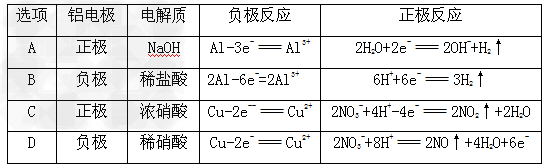
其中正确的是____________?,由此推知,金属作电极不仅与本身性质相关,而且与? __________??有关。
参考答案:⑴C ;在硫酸铜溶液中加入铝片,无明显现象,再加入氯化钠(注
本题解析:
本题难度:一般
3、实验题 为分析某县城的空气质量情况,某校化学研究性学习小组的同学拟实验测定该县城空气中SO2的含量。
(1)检验SO2可选用________试液。
(2)SO2与酸性KMnO4溶液反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。该反应的现象是____________,SO2在该反应中显______(填“氧化”或“还原”)性。
(3)该小组的同学拟用下图所示装置运用(2)中的反应原理定量分析空气中SO2的含量
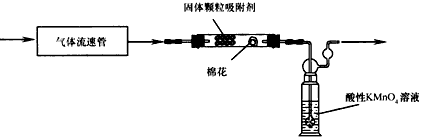
注:气体流速管是用来测量单位时间内通过气体的体积的装置
①装置中棉花的作用是________________,通入空气前应进行的实验操作是________________;
②该实验中需要知道的数据除气体流速、酸性KMnO4溶液的体积外还有____________________。
参考答案:(1)品红
(2)紫色溶液褪色;还原
(3)①
本题解析:
本题难度:一般
4、简答题 过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等。过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量。
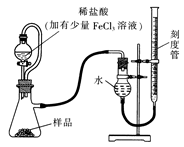
(1)某研究小组拟用右图装置测定一定质量的样品中过氧化镁的含量。
①实验前需进行的操作是????????????.稀盐酸中加入少量FeCl3溶液的作用是?????????????。
②用恒压分液漏斗的优点有:使分液漏斗中的溶液顺利滴下;?????????????????????。
③实验终了时,待恢复至室温,先?????????????,再平视刻度线读数。
(2)实验室还可通过下列两种方案测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。?
方案Ⅱ:称取0.1 g样品置于碘量瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗VmL Na2S2O3溶液。(已知:I2+2Na2S2O3= Na2S4O6+2NaI)
①已知常温下Ksp[Mg(OH)2]=l×10-11。为使方案I中Mg2+完全沉淀[即溶液中c(Mg2+)≤l ×10-5mol/L],溶液的pH至少应调至??????????。方案I中过氧化镁的质量分数为 ??????(用含a、b的表达式表示)。
②方案Ⅱ中滴定前需加入少量 ?????????作指示剂;样品中过氧化镁的质量分数为????????????(用含V的表达式表示)。
参考答案:
(1)①检查装置的气密性?用作催化剂(或催化H2O2
本题解析:
试题分析:(1)①该实验是测量气体体积的装置,故实验前要检查装置的气密性;②用恒压分液漏斗的优点为使分液漏斗中的溶液顺利滴下和消除滴入溶液的体积对所测气体体积的影响;③气体的体积受到温度和压强的影响,故读数前要恢复至室温和恢复到常压,即将右侧刻度管缓缓向下移动直到两侧液面相平;(2)①根据前后物质的变化确定质量减少的是氧原子,n(O)=(a-b)/16mol=n(CuO2),过氧化镁的质量分数为②(a-b)/16×56÷a=7(a-b)/2a;②碘参与或生成的反应均采用淀粉溶液做指示剂;方案Ⅱ涉及的反应为
MgO2+2HCl=MgCl2+H2O2
2HCl+H2O2+2KI=2H2O+I2
I2+2Na2S2O3= Na2S4O6+2NaI
所以n(MgO2)=1/2n(Na2S2O3)=0.05×V×10-3mol???
样品中过氧化镁的质量分数为=0.05×V×10-3×56/0.1=0.028V
本题难度:困难
5、选择题 下列实验操作错误的是
A.蒸馏时,锥形瓶(收集容器)口应用胶塞塞住,以防止蒸馏出的液体挥发
B.分液时,分液漏斗内的下层液体从下口放出,上层液体从上口倒出
C.从碘水中萃取碘出来,萃取剂应不溶于水,且比水更容易使碘溶解
D.蒸发时,玻璃棒的作用主要是搅拌
参考答案:A
本题解析:略
本题难度:简单