微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将物质的量均为0.1 mol K2SO4和Al2(SO4)3溶于水,向其中加入一定量的Ba(OH)2溶液,测得铝元素有一半留在溶液中,则生成BaSO4的物质的量可能为
A.0.15 mol
B.0.30 mol
C.0.35 mol
D.0.4 mol
参考答案:AC
本题解析:
试题分析:将物质的量均为0.1 mol K2SO4和Al2(SO4)3溶于水,则在溶液中SO42-的物质的量是n(SO42-)=0.1mol×1+0.1mol×3=0.4mol,Al3+的物质的量是:n(Al3+)=0.1mol×2=0.2mol。若向该溶液中加入的Ba(OH)2少量,铝元素有一半留在溶液中,则铝元素的存在形式为Al3+、Al(OH)3,形成Al(OH)3的物质的量为0.1mol,根据离子方程式:Al3++3OH-= Al(OH)3↓可知反应消耗OH-的物质的量为0.3mol,需要0.15mol的Ba(OH)2溶液,其产生的Ba2+的物质的量为0.15mol,根据离子方程式:Ba2++ SO42-=BaSO4↓,结合两种离子的物质的量关系可知SO42-过量,要按照因此Ba2+的物质的量计算;产生BaSO4的物质的量是0.15mol。若加入的Ba(OH)2过量,使一半Al(OH)3溶解变为AlO2-,则根据方程式:Al3++3OH-= Al(OH)3和Al3++4OH-= AlO2-+2H2O可知,形成0.1mol Al(OH)3需要消耗0.3mol OH-,形成0.1mol AlO2-需要消耗0.4mol OH-,则一共反应需要消耗OH-物质的量是0.7mol,应该由0.35mol Ba(OH)2提供。n(Ba2+)=0.35mol,而n(SO42-)=0.4mol,SO42-过量,产生BaSO4的物质的量是0.35mol,因此选项是AC。
考点:考查物质的量多少对反应产生的物质的影响的计算的知识。
本题难度:困难
2、填空题 计算下列各粒子的物质的量:
(1)6.02×1022个SO3分子中含有O原子的物质的量。______________
(2)含有6.02×1022个O原子的H2SO4的物质的量。____________
(3)含有6.02×1022个Fe3+离子的Fe2(SO4)3中SO42-的物质的量。____________
(4)含有6.02×1022个e-的H2O的物质的量。_____________
参考答案:(1) n(O)=0.1 mol×3=0.3 mol。 (2
本题解析:
本题难度:一般
3、选择题 设NA代表阿伏加德罗常数的数值。已知C2H4和C3H6的混合物的质量为a g,则该混合物( )
A.所含共用电子对数目为( +1)NA
+1)NA
B.所含碳氢键数目为 NA
NA
C.燃烧时消耗的O2一定是 L
L
D.所含原子总数为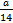 NA
NA
参考答案:B
本题解析:其最简式均为CH2,n(CH2)= ?mol,一个CH2可形成三个共用电子对,所含共用电子对数=
?mol,一个CH2可形成三个共用电子对,所含共用电子对数=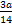 ?mol,A选项错误
?mol,A选项错误
本题难度:一般
4、选择题 设NA表示阿伏加德罗常数,下列叙述中正确的是
A.1L1mol·L-1的盐酸溶液中,所含氯化氢分子数为NA
B.1molNa2O2与水充分反应,转移电子数为1NA
C.标准状况下,22.4 L己烷所含分子数为NA
D.1.8g重水中所含质子数为NA
参考答案:B
本题解析:略
本题难度:一般
5、选择题 用NaCl固体配制一定物质的量浓度的溶液时,操作要领包括:①溶解,②定容,③转移,④计算,⑤称量等方面,其正确的操作顺序是( )
A.①②③④⑤
B.④①②③⑤
C.④⑤①③②
D.④⑤③②①
参考答案:配制一定物质的量浓度的氯化钠溶液的步骤为:计算、称量、溶解、
本题解析:
本题难度:一般