微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有钙、铁、镁等离子)制备BaCl2·2H2O,工艺流程如图所示。已知常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4。
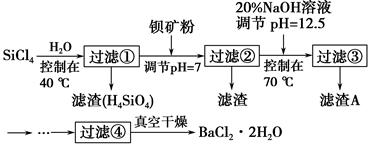
(1)SiCl4水解控制在40 ℃的原因是___________________________________。
已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)?ΔH1=+47 kJ·mol-1
Si(s)+3HCl(g)=SiHCl3(s)+H2(g)?ΔH2=-189 kJ·mol-1
则由SiCl4制备硅的热化学方程式为__________________________________。
(2)加钡矿粉时生成BaCl2的离子反应方程式是_________________________。
(3)加20% NaOH溶液调节pH=12.5,得到滤渣A的主要成分是________,控制温度70 ℃的目的是____________________________________________。
(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到BaCl2·2H2O。实验室中蒸发浓缩,用到的含硅酸盐的仪器有__________种。
(5)为体现该工艺的绿色化学思想,该工艺中能循环利用的物质是____________。
参考答案:(1)防止HCl挥发污染环境或控制SiCl4的水解速率,防止
本题解析:根据题中信息SiCl4与水反应时,强烈水解并放出大量的热,控制温度较低,可以降低反应速率,减少HCl的挥发。将题给的两个热化学方程式相减,便得到制硅的热化学方程式。(2)过滤后溶液为盐酸,与碳酸钡发生反应,碳酸钡难溶,写离子方程式时,应保留化学式。(3)根据题中的信息,常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4,因此调节pH=7时滤渣的主要成分是Fe(OH)3,pH=12.5时滤渣的主要成分是Mg(OH)2,同时控制温度较高时,Ca(OH)2溶解度减小,有Ca(OH)2生成。(4)蒸发浓缩时,需要用到酒精灯、蒸发皿、玻璃棒。(5)过滤④的滤液中含有大量的氯化钡,可以循环利用。
本题难度:一般
2、选择题 某KNO3溶液中含杂质KCl、K2SO4和Ca(NO3)2,现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是:
A.Ba(NO3)2、K2CO3、AgNO3、HNO3
B.K2CO3、Ba(NO3)2、AgNO3、HNO3
C.Ba(NO3)2、K2CO3、HNO3、AgNO3
D.AgNO3、Ba(NO3)2、K2CO3、HNO3
参考答案:D
本题解析:氯化钾用硝酸银除去,硫酸钾用硝酸钡除去,硝酸钙用碳酸钾除去,由于过量的硝酸钡和硝酸银需要用碳酸钾来除,所以正确的答案选D。
本题难度:一般
3、选择题 分液漏斗是把密度不同且互不相溶的液体分离的仪器。下列各组物质中,能用分液漏斗进行分离的是
A.四氯化碳和液溴
B.汽油和花生油
C.苯和食盐水
D.酒精和水
参考答案:C
本题解析:能用分液漏斗分离则混合物为互不相溶的液体混合物
A错,液溴易溶于四氯化碳;B错,汽油和花生油互溶;C正确,苯与食盐水互不相溶;D错,酒精和水互溶;
本题难度:简单
4、实验题 (16分)四只未贴标签的试剂瓶中分别盛装有NaNO3溶液、Na2CO3溶液、Na2SO4溶液和NaCl溶液,通过下列实验将四种溶液分别检出,请按实验步骤回答下列问题。
在四支试管中分别取四种溶液各1mL,完成下列实验。
(1)在四支试管中分别滴入???????,出现????????现象的是??????,离子反应方程式是????? ??????????????????????。
??????????????????????。
(2)在剩余三支试管中分别滴入????????,出现?????????现象的是??????,离子反应方程式是?????????????????????????????。
(3)在剩余两支试管中分别滴入???? ????,出现????????现象的是???????, 离子反应方程式是?????????????????????????????????。三次实验中都没有明显现象的是????????????。
????,出现????????现象的是???????, 离子反应方程式是?????????????????????????????????。三次实验中都没有明显现象的是????????????。
参考答案:(每空1分,离子方程式2分,无“↑”“↓”扣1分。共16分)
本题解析:略
本题难度:一般
5、选择题 将等物质的量的K2SO4、NaCl、Ba(NO3)2、AgNO3混合均匀后,置于容器中,加入足量的水,搅拌,静置,过滤。取滤液,用铂电极电解一段时间,则两极区析出的氧化产物和还原产物的质量比为
A.35.5︰108
B.108︰71
C.8︰1
D.1︰2
参考答案:C
本题解析:首先四物质在溶液中反应恰好生成BaSO4、AgCl沉淀,剩下的溶液电解相当于电解水,故在阴极和阳极分别产生的氢气和氧气,质量比为1:8;
本题难度:困难