微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应8NH3+3Cl2====6NH4Cl+N2中氧化产物和还原产物个数之比为(??? )
A.8∶3
B.3∶8
C.6∶1
D.1∶6
参考答案:D
本题解析:氧化产物为N2,还原产物为NH4Cl。
本题难度:简单
2、填空题 (12分)⑴同温同压下,同体积的H2和CO2物质的量之比为???????????????????,原子个数之比为????????????????,质量比为(最简整数比)??????????????????。
⑵用化学用语表示下列过程:
用离子方程式表示铝粉与氢氧化钠溶液的反应
??????????????????????????????????????????? ???????????
???????????
用化学方程式表示铁和水蒸气的反应,并用双线桥标出电子转移的方向和数目
????????????????????????????????????????????????????????
用离子方程式表示钠与水的反应,并用单线桥标出电子转移的方向和数目
????????????????????????????????????????????????????????
参考答案:(12分)1∶1,2∶3,1∶22(每空1分)方程式略(每空
本题解析:略
本题难度:一般
3、实验题 (15分)
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水。某化学兴趣小组准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ.测定过氧化氢的含量
(1)??????实验室准确配制250mL过氧化氢溶液, 除了要用到托盘天平、烧杯、量筒、药匙、玻璃棒外,还必须用到的仪器是___________、???????????????。(填仪器名称)。取配制好的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,作被测试样。
(2)??????用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。

(3)???滴定时,将高锰酸钾标准溶液注入___________________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是_________________??????????? ______。
(4)?重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为_________________________________。
(5)?若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
根据下面所提供的实验条件设计两个实验:分别证明过氧化氢的 氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
实验内容
| 实验方法
| 实验现象
|
验证氧化性
| ?
| ?
|
验证不稳定性
| ?
| ?
参考答案:
 本题解析:略 本题解析:略
本题难度:一般
4、填空题 某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为: ①取少量废液,滴加KSCN溶液显红色.②取10mL废液,加入足量的AgNO3溶液,析出沉淀8.61g.③另取10mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了0.256g,再向反应后的溶液中滴加KSCN溶液不变色.根据探究实验得出结论:
(1)废液中含有的金属离子是??????????????????????????????????????。
(2)求10mL废液中氯离子的物质的量浓度?
(3)求10mL废液中铜离子的物质的量是 ?
参考答案:(1) 本题解析: 本题解析:
试题分析:(1)依据元素化合价变化升降数值,结合氧化还原反应的双线桥标出电子转移方向和数目;锰元素化合价从+7价降低到+2价,得到5个电子;氯元素化合价从-1价升高为0价,失去1个电子,所以双线桥表示为: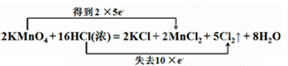 ;(2)依据化学方程式和元素化合价变化判断电子转移,计算被氧化的物质的量;2KMnO4+16HCl( ;(2)依据化学方程式和元素化合价变化判断电子转移,计算被氧化的物质的量;2KMnO4+16HCl(
本题难度:一般
5、填空题 (10分)(I)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,氢氧化锌溶于氨水可以生成Zn(NH3)42+。回答下列问题:
(1)写出锌和氢氧化钠溶液反应的化学方程式????????????????????????????。
(2)写出可溶性铝盐与过量氨水反应的离子方程式?????????????????????????????。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因????????????????????????????????????????????。
(II)环境专家认为可以用金属镁将水体中的NO 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Mg、OH 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Mg、OH 、Mg(OH)2、NO 、Mg(OH)2、NO 、N2,请将各粒子分别填入以下空格内(不用配平)。 、N2,请将各粒子分别填入以下空格内(不用配平)。

该反应过程中,被氧化与被还原的元素的物质的量之比为???????????。
参考答案:(10分)(I)(1)Zn+2NaOH═Na2ZnO2+H2
本题解析:
试题分析:本题给出的信息“锌的氢氧化物既能溶于强酸,又能溶于强碱。氢氧化锌溶于氨水可以生成Zn(NH3)42+。”学生没有学过,考查学生接受信息、处理信息的能力。
(1)锌与氢氧化钠反应可以类比铝与氢氧化钠反应:2Al+2H2O+2NaOH==2NaAlO2+3H2↑,则锌也生成类似的Na2ZnO2,所以方程式写成Zn+2NaOH═Na2ZnO2+H2↑[或Zn+2NaOH+2H2O═Na2Zn(OH)4+H2↑]
(2)因为氢氧化铝只能溶于强酸和强碱溶液,不能溶于弱酸和弱碱,所以铝盐
本题难度:一般
|