微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某同学需配制100 g 12%的NaOH溶液来制作“叶脉书签”。在配制溶液过程中,下列做法正确的是 [???? ]
A.称量前发现指针向右偏,应调节螺母至平衡
B.在托盘上垫纸称量12g NaOH固体
C.用100mL量筒量取88 mL水
D.用药匙搅拌,加速NaOH溶解
参考答案:AC
本题解析:
本题难度:简单
2、选择题 设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1mol苯分子含有3NA个C-C键
B.一定条件下,1mol N2和3mol H2充分混合,反应后转移的电子数为6NA
C.常温下,78.0g Na2O2与58.5g NaCl所含阴离子数相等
D.标准状况下,2.24L CCl4所含分子数为0.1 NA
参考答案:C
本题解析:
试题分析:A、苯分子中不存在碳碳单键,A错误;B、氨的合成是可逆反应,因此一定条件下,1mol N2和3mol H2充分混合,反应后转移的电子数小于6NA,B错误;C、常温下,78.0g Na2O2与58.5g NaCl所含阴离子数相等,均是NA个,C正确;D、标准状况下四氯化碳不是气态,不能适用于气体摩尔体积,D错误,答案选C。
考点:考查阿伏伽德罗常数的计算
本题难度:一般
3、选择题 已知:一般溶液浓度越大密度越大,氨水等例外。则体积为vL、质量为mg,浓度为a mol/L的氨水溶液的溶质质量分数为b%,用水稀释到0.5a mol/L,下列说法正确的是
A.加水的体积为vL
B.加水的质量为mg
C.0.5amol/L的氨水质量分数等于0.5b%
D.0.5amol/L的氨水质量分数小于0.5b%
参考答案:D
本题解析:
试题分析:A、氨水溶液的浓度越大,密度越小。加入等体积的水,溶液的质量分数小于0.5b%,但氨水溶液的密度增大,所以根据c= 可知,此时溶液的浓度不一定是0.5amol/L,A错误;B、如果加入等质量的水,则溶液的质量分数等于0.5b%,但氨水溶液的密度增大,所以根据c=
可知,此时溶液的浓度不一定是0.5amol/L,A错误;B、如果加入等质量的水,则溶液的质量分数等于0.5b%,但氨水溶液的密度增大,所以根据c= 可知,此时溶液的浓度大于0.5amol/L,B错误;C、0.5amol/L的氨水溶液的密度大于浓度为a mol/L的氨水溶液的密度,因此根据c=
可知,此时溶液的浓度大于0.5amol/L,B错误;C、0.5amol/L的氨水溶液的密度大于浓度为a mol/L的氨水溶液的密度,因此根据c= 可知,0.5amol/L的氨水溶液的质量分数小于0.5b%,C错误;D、根据C中分析可知0.5amol/L的氨水溶液的质量分数小于0.5b%,D正确,答案选D。
可知,0.5amol/L的氨水溶液的质量分数小于0.5b%,C错误;D、根据C中分析可知0.5amol/L的氨水溶液的质量分数小于0.5b%,D正确,答案选D。
考点:考查物质的量浓度与质量分数的有关计算
本题难度:一般
4、选择题 如图是NaCl、MgSO4的溶解度曲线。下列说法正确的是 ( )
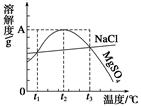
A.只有在t1℃时,NaCl和MgSO4的溶解度才相等
B.t1~t2℃,MgSO4的溶解度随温度升高而减小
C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大
D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出
参考答案:C
本题解析:A项,t1℃、t3℃时,NaCl、MgSO4的溶解度相等;B项,t2之前,MgSO4的溶解度随温度的升高而增大,t2之后,随温度的升高而降低;C项,w= ×100%,S越大,w越大;D项,把MgSO4饱和溶液的温度从t3℃降至t2℃时,由饱和溶液变成不饱和溶液,不会有晶体析出。
×100%,S越大,w越大;D项,把MgSO4饱和溶液的温度从t3℃降至t2℃时,由饱和溶液变成不饱和溶液,不会有晶体析出。
本题难度:一般
5、选择题 下列选项中所涉及到的两个量的一定相等的是
A.11. 2LCl2与4.25gNH3所含有的原子数
B.18.0g重水(D2O)与20gNe所含有的电子数
C.标准状况下36gH2O与1.204×1024个O2分子所占的体积
D.等物质的量的Al分别与足量的盐酸、NaOH溶液反应转移的电子数
参考答案:D
本题解析:
试题分析:A、11. 2LCl2因为状态不确定,所以确定不了物质的量,原子数无法确定,4.25gNH3所含有的原子数: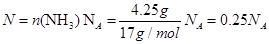 ,错误;B、18.0g重水(D2O)所含有的电子数为0.9NA,20gNe所含有的电子数为NA,错误;C、水是液体,错误;D、不管与酸还是碱反应,等物质的量的铝所失去的电子都是相同的。正
,错误;B、18.0g重水(D2O)所含有的电子数为0.9NA,20gNe所含有的电子数为NA,错误;C、水是液体,错误;D、不管与酸还是碱反应,等物质的量的铝所失去的电子都是相同的。正
本题难度:简单