微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在25?mL?0.1?mol·L-1?NaOH溶液中逐滴加入0.2?mol·L-1 CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是??????????????????????
 [???? ]
[???? ]
A.对于曲线上AB间任一点,溶液中都有: c(Na+)?>c(CH3COO-)?>c(OH-)?>c(H+)
B.在B点,a>12.5,且有 c(Na+)?=?c(CH3COO-)?=?c(OH-)?=?c(H+)
C.在C点,c(CH3COO-)?-?c(Na+)?=?c(H+)?-?c(OH-)
D.在D点,c(CH3COO-)?+?c(CH3COOH)?=?c(Na+)
2、选择题 下列化学原理表述正确的是[???? ]
A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大
B.Na2CO3溶液中满足:c(?Na+)==2c(CO32-)+2c(HCO3-?)+2c(H2CO3)
C.NaHCO3溶液不显中性的原因:HCO3-?+H2O CO32-?+H3O+
CO32-?+H3O+
D.同体积同pH的盐酸和醋酸,与足量的锌反应,盐酸的反应速度快,生成H2的物质的量多
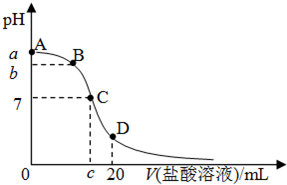
3、选择题 25℃,在20mL?0.1mol/L?氨水溶液中逐滴加入0.2mol/LHCl溶液(如图),下列说法正确的是( )
A.在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B.在C点,c<10,且有c(NH4+)=c(Cl-)=c(OH-)=c(H+)
C.若25℃时?0.1mol/L?氨水电离度为1.33%,则b<a<12
D.在D点:2c(NH4+)+2c(NH3?H2O)=c(Cl-)
4、选择题 下列各组解释合理的是[???? ]
物质的检验、制备和用途及实验现象
解释
A.
在一定浓度的乙酸溶液中加入少量乙酸钠固体,溶液pH增大?
完全是由于乙酸根水解所致
B.
向少量未知溶液中滴加氯化钡溶液,有白色沉淀生成
该溶液中一定含有SO42-
C.
常温下可用铁或铝制容器来盛装浓硫酸或浓硝酸
铁、铝表面发生了钝化现象
D.
向饱和NaCl溶液中通入足量的NH3和CO2,有NaHCO3固体析出
NaHCO3是难溶于水的盐
5、选择题 25℃时,下列各溶液中有关物质的量浓度关系不正确的是[???? ]
A.Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.0.1mol/L?pH为4的NaHB溶液中:c(HB-)>c(B2-)>c(H2B)
C.NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D.0.2mol/L的某一元弱酸HA溶液和0.1mol/LNaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)=2c(H+)+c(HA)