微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.1molH+的质量是1g
B.H2的摩尔质量是2g
C.1molO2的质量是32g/mol
D.1molNa+的质量是11g
参考答案:A
本题解析:分析:A、利用m=n×M来计算;
B、摩尔质量的单位是g/mol;
C、质量的单位是g;
D、利用m=n×M来计算.
解答:A、1molH+的质量是1mol×1g/mol=1g,故A正确;
B、H2的摩尔质量是2g/mol,故B错误;
C、1molO2的质量是1mol×32g/mol=32g,故C错误;
D、1molNa+的质量是1mol×23g/mol=23g,故D错误;
故选A.
点评:本题考查质量、摩尔质量、物质的量的关系及计算,明确m=n×M及单位即可解答,注意离子的质量与原子的质量近似相等,忽略电子的质量来解答.
本题难度:简单
2、选择题 50mL 0.6mol?L-1NaOH溶液,含NaOH的物质的量为
A.0.03?mol
B.0.04?mol
C.0.05?mol
D.0.06?mol
参考答案:A
本题解析:分析:根据n=cV计算氢氧化钠的物质的量.
解答:50mL0.6mol?L-1NaOH溶液,含NaOH的物质的量为0.05L×0.6mol/L=0.03mol,故选A.
点评:本题考查物质的量浓度的有关计算,比较基础,旨在考查学生对基础知识的理解掌握.
本题难度:困难
3、选择题 下列表中对于相关物质的分类全部正确的一组是
A.明矾? 蔗糖 NaHCO3 CO2
B.天然橡胶? 石膏? SO2 CH3CH2OH
C.冰? 王水? H2SiO3 Cl2
D.胆矾? 玻璃 H2CO3 NH3
参考答案:D
本题解析:分析:依据概念分析判断,纯净物是同种物质组成的,分为单质和化合物;混合物是不同物质组成的主要是溶液、胶体、浊液等;弱电解质是水溶液中部分电离的化合物;非电解质是在水溶液和熔融状态下都不导电的化合物;
A、蔗糖是纯净物;
B、天然橡胶是混合物,二氧化硫属于非电解质;
C、Cl2是单质,不符合非电解质概念;
D、胆矾属于纯净物,玻璃是混合物,H2CO3 是弱酸,NH3是非电解质.
解答:A、蔗糖是纯净物,故A错误;
B、天然橡胶是高分子化合物属于混合物,石膏是纯净物,二氧化硫属于非电解质,故B错误;
C、氯气是单质不是非电解质,故C错误;
D、胆矾属于纯净物,玻璃是混合物,H2CO3 是弱酸,NH3 是非电解质,故D正确;
故选D.
点评:本题考查了化合物、混合物、电解质、非电解质、概念的应用判断,熟悉物质的组成,理解概念的含义是解题关键.
本题难度:简单
4、选择题 NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,11.2L水中含有分子的数目为0.5NA
B.100mL0.2mol?L-1的FeCl3溶液中,含Fe3+数为0.02NA
C.1mol?Cl2与足量的NaOH溶液反应,转移的电子数为1NA
D.在密闭容器中加入0.5molN2和l.5mol?H2,充分反应后可得到NH3分子数为NA
参考答案:C
本题解析:分析:A、标准状况下,水不是气体;
B、三价铁离子水溶液中发生水解;
C、氯气和氢氧化钠的反应是氯气自身氧化还原反应,化合价从0价变化为-1价和+1价;
D、氮气和氢气合成氨是可逆反应不能进行彻底;
解答:A、标准状况下,11.2L水物质的量不是0.5mol,故A错误;
B、100mL0.2mol?L-1的FeCl3溶液中含三价铁离子物质的量为0.02mol,但铁离子水溶液中发生水解,所以溶液中含Fe3+数小于0.02NA,故B错误;
C、1mol Cl2与足量的NaOH溶液反应,氯气和氢氧化钠的反应是氯气自身氧化还原反应,化合价从0价变化为-1价和+1价,转移的电子数为1NA,故C正确;
D、在密闭容器中加入0.5molN2和l.5mol H2,反应是可逆反应不能进行彻底;充分反应后可得到NH3分子数小于NA,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的条件应用,盐类水解的特征,氧化还原反应的电子转移数目计算,可逆反应的应用,题目较简单,D选项是易错点.
本题难度:一般
5、选择题 将1L0.2mol/L?NaCl溶液和1L0.2mL/L?Na2SO4溶液混合,若溶液的体积为二者体积之和,则混合溶液中钠离子浓度为
A.0.2mol/L
B.0.3mol/L
C.0.6mol/L
D.0.8mol/L
参考答案:B
本题解析:分析:0.2mol/L?NaCl溶液中钠离子浓度为0.2mol/L,0.2mL/L?Na2SO4溶液中钠离子浓度为0.4mol/L,根据n=cV计算钠离子的物质的量,混合后溶液中的钠离子的物质的量等于氯化钠溶液与硫酸钠溶液含有的钠离子之和,再根据c=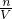 计算.
计算.
解答:解0.2mol/L?NaCl溶液中钠离子浓度为0.2mol/L,1L氯化钠溶液中钠离子的物质的量为1L×0.2mol/L=0.2mol,
0.2mL/L?Na2SO4溶液中钠离子浓度为0.4mol/L,1L硫酸钠溶液中钠离子的物质的量为1L×0.4mol/L=0.4mol,
混合后溶液中的钠离子物质的量为0.2mol+0.4mol=0.6mol,
故混合溶液中钠离子浓度为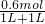 =0.3mol/L
=0.3mol/L
故选B.
点评:本题考查物质的量浓度的有关计算,比较基础,注意公式的理解与灵活运用.
本题难度:简单