微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 能源是人类生活和社会发展的物质基础,研究化学反应中的能量变化,有助于更好地利用化学反应为人们的生产和生活服务。回答下列问题:
(1)从能量的角度看,断开化学键要____,形成化学键要___。已知拆开1 mol H-H键、1 mol I-I键、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ和299 kJ。则由氢气和碘反应生成1 mol HI需要___kJ 的热量(注明“放出”或“吸收”)。
(2)在生产和生活中经常遇到化学能与电能的相互转化。在如图甲所示的装置中,负极的电极反应式为______,总反应方程式为___。 Cu片附近pH____。当导线中有2 mol e-通过时,理论上两极的变化是:负极溶解了___g锌,正极上生成___g氢气。
(3)乙装置中铝电极作____极,被____(填“氧化”或“还原”)。?

参考答案:(1)吸收能量;放出能量;放出5.5
(2)Zn-2
本题解析:
本题难度:一般
2、选择题 将质量分数为0.052(5.2%)的NaOH溶液1 L(密度为1.06 g·cm-3)用铂电极电解,当溶液中的NaOH的质量分数改变了0.010(1.0%)时停止电解,则此时溶液中应符合的关系是( )
?
| NaOH的质量分数
| 阳极析出物
的质量/g
| 阴极析出物
的质量/g
|
A
| 0.062(6.2%)
| 19
| 152
|
B
| 0.062(6.2%)
| 152
| 19
|
C
| 0.042(4.2%)
| 1.2
| 9.4
|
D
| 0.042(4.2%)
| 9.4
| 1.2
?
参考答案:B
本题解析:根据电解NaOH溶液事实上是电解水这一结论,可看出随着电解的进行,溶液中溶质的质量数增加,这样,C、D两选项应予否定。电解水时阳极析出的是氧气,阴极析出的是氢气,它们的物质的量之比应为2 ∶1,前者的质量应大于后者,当然只有选项B正确。
本题难度:一般
3、选择题 如右图所示装配好仪器,接通直流电源,电解饱和食盐水,则电解一段时间后,在碳棒和铁钉表面都有气体生成,其中碳棒表面生成的气体是
A.Cl2
B.O2
C.H2
D.HCl
参考答案:A
本题解析:略
本题难度:一般
4、选择题 将含有0.4molCu(NO3)2和0.4molKCl的水溶液1L用惰性电极电解一段时间后 ,在一个电极上析出0.3molCu,此时在另?一个电极上放出气体的体积(标准状况)约为(????)。
A.5 .6L
B.6.72L
C.2.8L
D.13.44L
参考答案:A
本题解析:
试题分析:在阴极析出0.3molCu,则电路中转移了0.6mol电子。阳极有0.4molCl-失电子,失去0.4mol电子,产生0.2molCl2,另外还有0.2mol电子是OH-失去的,产生0.05molO2,因此一共产生标准状况下的气体5.6L,A正确。
点评:考查电解池的原理,具有一定的难度,侧重考查学生的逻辑推理能力和分析问题的能力,解题的关键是找出电极反应得失电子的情况,从而准确解答。
本题难度:简单
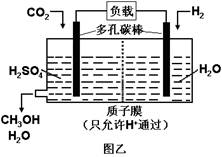
5、选择题 下图甲是CO2电催化还原为碳氢化合物的工作原理示意图,用一种钾盐水溶液作电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,硫酸为电解质溶液。下列说法不正确的是
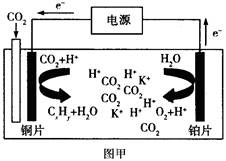 ??? ???
A.甲中铜片作阴极,K+向铜片电极移动
B.乙中正极发生的电极反应为CO2+6e-+6H+=CH3OH+H2O
C.甲中若CxHy为C2H4,则生成1 mol C2H4的同时生成2 molO2
D.乙中H2SO4的作用是增强溶液的导电性
参考答案:C
本题解析:
试题分析:A、根据装置图可知,铜片是电子流入的,因此该电极是阴极,溶液中的阳离子向负极移动,A正确;B、乙图中氢气在负极通入,CO2在正极通入,由于存在质子交换膜,因此正极电极反应式为CO2+6e-+6H+=CH3OH+H2O,B正确;C、二氧化碳中碳元素是+4价,甲中若CxHy为C2H4,则生成1 mol C2H4,转移电子的物质的量是2×[4-(-2)]=12mol,所以根据电子得失守恒可知,同时生成3molO2,C不正确;D、硫酸是强酸,完全电离,因此乙中H2SO4的作用是增强溶液的导电性,
本题难度:一般
|