错误,氯化铵溶解于水是物理变化,不能写离子方程式
?
参考答案:B
本题解析:Al(OH)3只能溶于强碱溶液,不溶于NH3·H2O,A项评价错误;用氨水吸收过量SO2,其产物应为NH4HSO3,C项错误;NH4Cl溶于水,N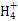 水解,是化学变化,D项评价错误。 水解,是化学变化,D项评价错误。
本题难度:一般
2、填空题 下图所示是中学化学里常见纯净物A—L间的反应关系,其中A、H、E、F为单质且E、F为气体,B在常温下是无色液体,C是淡黄色固体,L是红褐色固体。
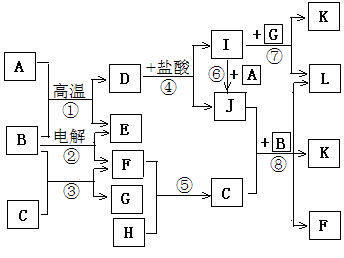
请根据图示判断并回答下列问题:
(1)单质A中所含元素在周期表中的位置是??????;
(2)反应③的化学方程式为???????????????????????????;
(3)反应④的离子方程式为???????????????????????????;
(4)反应⑧的离子方程式为???????????????????????????;
(5)反应②发生过程中,当有3.01×1024个电子发生转移时,电解消耗物质B的质量为?????g,同时阴极生成的气体的体积为???L(换算为标准状况下的体积)。
参考答案:(1)第四周期Ⅷ族(2分)
(2)2Na2O2+2H2
本题解析:
试题分析:本题突破点在与B在常温下是无色液体,故B为谁,C为淡黄色固体,能与水反应生成G溶液与F气体单质,故C为Na2O2,G为NaOH,F为O2;L为红褐色固体,为Fe(OH)3,由D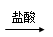 I溶液可知I为FeCl3,J为FeCl2,A为单质铁。从而可以推导出其他物质分别为:A为Fe,B为H2O,C为Na2O I溶液可知I为FeCl3,J为FeCl2,A为单质铁。从而可以推导出其他物质分别为:A为Fe,B为H2O,C为Na2O
本题难度:困难
3、选择题 下列说法及对应化学方程式或离子方程式正确的是
A.84消毒液与洁厕灵混合可能产生毒气: ClO- + Cl- + 2H+ = Cl2↑ + H2O
B.用二氧化硅和水反应可制得硅酸: SiO2 + H2O = H2SiO3
C.食醋与蛋壳反应: CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O
D.铁在氯气中燃烧: Fe + Cl2 = FeCl2
参考答案:A
本题解析:
试题分析:A、84消毒液的主要成分是次氯酸钠,洁厕灵显酸性,二者混合会发生氧化还原反应,产生有毒的氯气,正确;B、二氧化硅和水不反应,不能制取硅酸,错误;C、食醋的主要成分是醋酸,醋酸是弱酸,不能拆开,错误;D、铁与氯气反应生成+3价的氯化铁,错误,答案选A。
本题难度:一般
4、选择题 下列离子方程式书写正确的是:
A.碳酸氢镁溶液中加入过量的NaOH溶液:Mg2++2HCO3-十4OH一=Mg(OH)2 ↓2H2O+2CO32—
B.NaHSO4溶液与Ba(OH)2溶液混合后显酸性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.少量C12通入水中:Cl2 +H2O 2H++C1O-十C1- 2H++C1O-十C1-
D.酸性高锰酸钾可使草酸溶液褪色:2MnO4-+5C2O42-+16H+= 2Mn2++ l0CO2 ↑+8H2O
参考答案:A
本题解析:
试题分析:A、碳酸氢镁完全电离产生Mg2+、2HCO3-,二者都可与NaOH反应,所以离子方程式为Mg2++2HCO3-十4OH一=Mg(OH)2 ↓2H2O+2CO32—,正确;B、Ba(OH)2完全电离产生Ba2+、2OH-,而所给方程式中只用掉1个OH-,说明溶液中仍存在OH-,则溶液显碱性,与已知矛盾,错误;C、C12与水反应生成的次氯酸是弱酸,不能拆开,错误;D、草酸是弱酸,不能拆开,错误,答案选A。
本题难度:一般
5、选择题 下列离子方程式书写正确的是(?? )
A.FeO固体放入稀硝酸溶液中:FeO+2H+====Fe2++H2O
B.过量的铁粉与稀硝酸溶液反应:Fe+4H++NO3-====Fe3++NO↑+2H2O
C.向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+====Fe2++2H2O
D.向Fe (OH)3中加入氢碘酸:2Fe(OH)3+6H++2I-====2Fe2++I2+6H2O
参考答案:D
本题解析:
试题分析:A、不管是稀硝酸还是浓硝酸,其氧化性都很强,故与之反应,元素的化合价都升高到最高价,故Fe元素的反应产物应该为Fe3+.
B、过量的铁粉与稀硝酸反应,三价的铁最后应被还原为二价。
C、原理和A选项一样。
点评:此题考核了铁元素和硝酸间的反应,要掌握好硝酸不管它的稀浓,最终产物都是最高价,同时,也要注意铁三角间的互相转化。
本题难度:简单
|