微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 I、II为两个极易导热的密闭容器,I保持容积不变,II中的活塞可上下移动,以保持内外压强相等。在相同条件下将3 mol A和1 mol B分别同时混合充入I、II两容器中,发生反应3A(g)+B(g) 2C(g)+D(g)
2C(g)+D(g)
(1)达到平衡时,I中A的浓度为M mol/L,C的浓度为N mol/L,II中A的浓度为m mol/L,C的浓度为n
mol/L,则M_____m;N_____n;(填>、<、=)
(2)保持温度不变,若向I中的平衡体系中再充入2 mol C和1 mol D,重新达到平衡后A的浓度为R mol/L。则_________
A. R = 2M B. R < M C. M < R < 2M D. R > 2M
参考答案:(1)<;<
(2)C
本题解析:
本题难度:一般
2、选择题 下图中,P为可自由滑动的活塞,关闭K,V(A)=aL,V(B)=0.8aL(连通管的体积忽略不计)。在相同温度和有催化剂存在的条件下,分别向容器A、B中各充入1molN2和3molH2,发生反应N2(g)+3H2(g)  ?2NH3(g);ΔH=-92.4kJ/mol。达到平衡后,V(B)=0.6aL。
?2NH3(g);ΔH=-92.4kJ/mol。达到平衡后,V(B)=0.6aL。

⑴B中N2的转化率是???????。A中N2的转化率??????(填“大于”、“等于”或“小于”)B中N2的转化率。理由是???????????????????????????????????????。
⑵打开K,一段时间后反应再次达到平衡,则B的体积为???????。请说明理由?
⑶A反应达到平衡时,放出akJ的热量,若向A中充入2molNH3,在相同条件下达到平衡时吸收热量为bkJ,则a和b的关系是??????????????。
⑷B中反应达到平衡后,只改变下列条件,c(NH3)不改变的是?????(填序号)。
A.升高温度?????????????????????????? B.向容器充入1molAr(g)
C.向容器中充入2molNH3?????????????? D.选用效果更好的催化剂
参考答案:⑴50%,小于,A容积不变,而B容积缩小,所以A中容器压强小
本题解析:略
本题难度:一般
3、选择题 某固定体积的密闭容器中,加入一定量的A达化学平衡:aA(g)  bB(g)+cC(g),在温度不变的条件下,再充入一定量的A,重新达到平衡时,下列判断中正确的是
bB(g)+cC(g),在温度不变的条件下,再充入一定量的A,重新达到平衡时,下列判断中正确的是
A.若a=b+c时,B的物质的量分数变大
B.若a=b+c时,B的物质的量分数不变
C.若a>b+c时,A的转化率不变
D.若a<b+c时,A的转化率变大
参考答案:B
本题解析:由于反应物只有A一种,所以再充入一定量的A,相当于增大压强,所以如果a=b+c时,则平衡不移动,平衡是等效的,选项A不正确,B正确;如果a>b+c时,则平衡向正反应方向移动,A的转化率增大,选项C不正确;若a<b+c时,则平衡向逆反应方向移动,A的转化率减小,答案选B。
本题难度:一般
4、填空题 (9分)已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
温度
| K1
| K2
|
973 K
| 1.47
| 2.38
|
1173 K
| 2.15
| 1.67
请填空:
(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g) ??CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________. ??CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________.
(3)根据反应①与②可推导出K1、K2与K3之间的关系式________,据此关系式及上表数据,也能推断出反应③是________(填“吸热”或“放热”)反应.
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有________(填写字母序号).
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
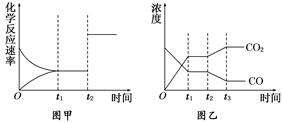
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
①图甲中t2时刻发生改变的条件是_____________________________________.
②图乙中t2时刻发生改变的条件是_______________________________________.
参考答案:(9分)(1)反应①是吸热反应.(2)K3=<
本题解析:(1)根据表中数据可知,升高温度,K1是增大的,说明升高温度平衡向正反应方向进行,所以反应①是吸热反应。
(2)平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,平衡常数表达式是K3=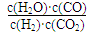 ?。 ?。
(3)根据盖斯定律可知,①-②即得到反应③,所以K3=K1/K2;升高温度,K1增大,K2增减小,所以K3是增大,因此正反应是吸热反应。
反应③是体积不变的、吸热的可逆反应,所以要使平衡向正反应方向移动,则可以升高温度,或降低生成物的浓度等,但压强和催化剂不能改变平衡状态,答案选CE。
(5)①图甲中t2时刻正逆反应速率都增大,但平衡不移动,所以改变的条件是增大压强或使用催化剂。
②图乙中t2时刻CO2的浓度增大,而CO的浓度降低,即平衡向逆反应方向进行,所以改变的条件是降低温度或从体系中分离出H2。
本题难度:一般
5、填空题 (14分)工业上以乙苯为原料生产苯乙烯的反应如下(Ph代表苯基):
Ph—CH2CH3(g) Ph—CH=CH2(g)+H2(g)?△H Ph—CH=CH2(g)+H2(g)?△H
某研究小组为探究温度等因素对该反应的产率影响,在容积可变的密闭容器中分别作了四组实验,实验结果如下图a、b所示。
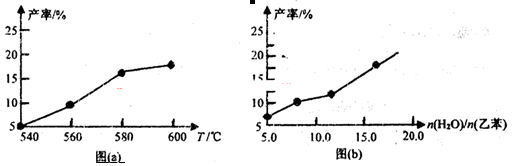
(1)根据反应及上图(a),判断△H?????0(填“<”“=”或“>”,下同),△S????0;请选择经济、且适宜的反应温度:????????。
(2)下列事实可以说明该反应已达平衡的是??????????。
A.混合气体的密度不再变化
B.氢气的体积分数保持不变
C.氢气、苯乙烯的生成速率之比保持不变
D.单位时间内消耗的n(乙苯)等于生成的n(H2)
(3)从压强因素分析,为提高乙苯的转化率,应采用??????的生产条件。实际工业生产中常采用通入水蒸气的方法。水蒸气的含量对反应的影响结果如上图(b)所示。
①在做这四组实验时,应该采用的其他实验条件是???????????。
A.反应温度相同?????????B.采用不同的催化剂
C.压强都控制在常压下??? D.反应相同时间时测定实验数据
②图(b)表明:???????????????????????????。
③一定温度下,在恒压密闭容器中,通入一定量n(H2O)/n(乙苯)=7:1的气体,发生上述反应,在t1时刻达到平衡。保持其他条件不变,此时分离出一定量的水蒸气,在t2时刻重新达到平衡,请在右图中画如反应再次达到平衡过程的图像。
参考答案:(1)>;>;580° (2)AB (3)低压 ①AC
本题解析:
试题分析:(1)根据图a可知,随着温度的升高产率逐渐增大。这说明升高温度平衡向正反应方向移动,因此正方应是吸热反应,即△H>0;根据反应的化学方程式可知,该反应是体积增大的可逆反应,因此△S>0。根据图a可知温度升高到580℃以后产率增加的不是很明显,因此适宜的温度应该是580℃。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,则A、密度是混合气的质量和容器容积的比值,在反应过程中质量始终是不变的,但容器容积是变化的,因此当密度不再发生变化时,可以说明反应达到平衡状态,A正确;B、氢气的体积分数保持不变可以说明反应达到平衡状态,B正确;C、根据反应速率之比是相应的化学计量数之比可知氢气、苯乙烯的生成速率之比始终保持不变,不能说明反应达到平衡状态,C不正确;D、根据反应速率之比是相应的化学计量数之比可知,单位时间内消耗的n(乙苯)等于生成的n(H2),因此不能说明反应达到平衡状态,D不正确,答案选AB。
(3)正方应是体积增大的可逆反应,所以从压强因素分析,为提高乙苯的转化率,应采用低压的生产条件。
①要探究水蒸气的含量对反应的影响结果,则根据定一议二的原则可知,其它反应条件应该是相同的,即温度、压强和催化剂均是相同的,答案选AC。
②根据图b可知,在恒温恒压条件下,n(H2O)/n(乙苯)的比值越高,产率越高。
③保持其他条件不变,此时分离出一定量的水蒸气,则导致容器内压强降低,因此要保持恒压则需要缩小容器的容积,因此相当于是增大压强,平衡向正反应方向移动,则图像可表示为 。 。
本题难度:一般
|