微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生反应: N2(g) + 3H2(g)  ?2NH3(g)
?2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)="13" mol,nt(NH3)="6" mol,计算a=??????????????。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量=???????????????。
(3)原混合气体与平衡混合气体的总物质的量之比n(始)∶n(平)=?????????????。
(4)原混合气体中,a∶b=?????????????。
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= ?????????????????。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=????????????????。
参考答案:(每空2分,共12分)
(1)16(2)8 mol(3
本题解析:
试题分析:(1)利用物质的量之比等于化学计量数之比,所以(a-13)mol:6mol=1:2,解得a=16,故答案为:16;
(2)反应达平衡时,混合气体为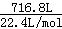 =32mol,其中NH3的物质的量为32mol×25%=8mol,故答案为:8mol;
=32mol,其中NH3的物质的量为32mol×25%=8mol,故答案为:8mol;
(3)由(1)知a=16mol,由(3)b=24mol,
所以故原混合气体为16mol+24mol=40mol,
由(3)知平衡混合气体的组成为:N212 mol,H212 mol,NH3为8 mol.
所以平衡混合气体的物质的量为12mol+12mol+8mol=32mol,
则原混合气体与平衡混合气体的物质的量之比n(始):n(平)=40mol:32mol=5:4,
故答案为:5:4;
(4)由(1)知a=16mol,由(3)b=24mol,所以a:b=16mol:24mol=2:3,
故答案为:2:3;(5)由(3)可知,开始是氢气的物质的量为24mol;
平衡时参加反应的氮气的物质的量为4mol,参加反应的氢气的物质的量为12mol,
所以达到平衡时,N2和H2的转化率之比α(N2):α(H2)=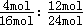 =1:2,
=1:2,
故答案为:1:2.
(6)N2 +3H2  2NH3,
2NH3,
开始(mol):16 b 0
变化(mol):4 12 8
平衡(mol):12 (b-12)8
平衡时,NH3的含量(体积分数)为25%,所以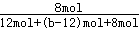 ×100%=25%,解得b=24,
×100%=25%,解得b=24,
所以平衡混合气的组成为:N212 mol,H212 mol,NH3为8 mol,
平衡混合气体中,n(N2):n(H2):n(NH3)=12mol:12mol:8mol=3:3:2,
故答案为:3:3:2。
91ExAm.org点评:本题考查化学平衡的有关计算,难度不大,注意基础知识的掌握与三段式解题法的步骤。
本题难度:一般
2、选择题 密闭容器中,反应xA(g)+yB(g)  zC(g)达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L下列判断错误的是?(???)??????????????????????????????????????????
zC(g)达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L下列判断错误的是?(???)??????????????????????????????????????????
A.x+y>z
B.平衡向正方向移动
C.B的转化率降低
D.C的体积分数下降
参考答案:B
本题解析:
试题分析:保持温度不变,将容器的容积扩大到原来的2倍的瞬间, A的浓度降为0.25mol/L.但达新平衡时A的浓度变为0.3mol/L,这说明降低压强,平衡向逆反应方向移动,即正反应是体积减小的可逆反应,所以x+y>z,因此选项B不正确,其余选项都是正确的,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。试题针对性强,难易适中,注重答题的灵活性,有利于培养学生的逻辑思维能力和创新思维能力。该题的关键是明确变化的瞬间与最终平衡时浓度的变化。
本题难度:简单
3、选择题 反应2A(g)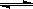 2B(g)+C(g)(正反应为吸热反应),达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是 ( )
2B(g)+C(g)(正反应为吸热反应),达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是 ( )
A.减压
B.降温
C.加压
D.增大B的浓度
参考答案:B
本题解析:由于本题并未严格说明减压、加压的方法,并且不知体系是否为定容或定压,所以ACD项无法满足题目要求,而降温一定可使正逆反应速率均降低,且平衡左移,A的浓度增大,故答案为B
本题难度:一般
4、填空题 在一定温度下,向一个5L的密闭容器中,通入2 mol N2和8 mol H2及固体催化剂,使之反应。已知:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1。平衡时容器内气体压强为起始时的80%。
2NH3(g) ΔH=-92.2 kJ·mol-1。平衡时容器内气体压强为起始时的80%。
(1)计算平衡时容器内NH3的体积分数为________,该该温度下该反应的平衡常数为:________。(利用三段式计算,要有过程)
(2)加入2 mol N2和8 mol H2,达到平衡时,放出热量为________(填序号)。
A.大于92.2 kJ B.等于92.2 kJ C.小于92.2 kJ D.可能大于或小于或等于92.2 kJ
(3)在相同容器中,降低温度,通入2 mol NH3和1 mol H2及固体催化剂,反应达到平衡时NH3的体积分数是否为1/4,下列判断正确的是________(填序号)。
A.一定等于1/4 B.一定大于1/4 C.一定小于1/4 D.可能大于或小于或等于1/4
参考答案:(1)25%;0.16
(2)B
(3)D
本题解析:
本题难度:一般
5、选择题 在一定温度下,可逆反应X(g)+3Y(g) 2Z(g)已达到平衡的是
2Z(g)已达到平衡的是
A.单位时间内消耗n mol X同时生成2n mol Z
B.单位时间生成a molX同时生成3a molY
C.X、Y、Z的浓度不再变化
D.X、Y、Z的分子数之比为1∶3∶2
参考答案:C
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。所以C正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此D不正确。A、B中反应速率的方向是相同的,所以不能说明,答案选C。
本题难度:一般