微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 每空2分,共10分)
(1)标准状况下,体积为11.2 L 的CO2的物质的量为 mol,质量为 g,其所含原子的总数为 。
(2)某金属氯化物为MCl2 9.5g,含有0.200molCl-,则该氯化物的摩尔质量 ,金属M的相对原子质量为 。
参考答案:(1)0.5mol 22g
本题解析:
试题分析:(1)根据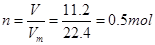 ,根据m=Nm=0.5mol×44g/mol=22g;一个二氧化碳分子中含有3个原子,所以其所含原子的总数为0.5mol×3×NA=9.03×1023。(2)Cl-的物质的量为0.200mol,所以MCl2的物质的量为0.100mol,根据
,根据m=Nm=0.5mol×44g/mol=22g;一个二氧化碳分子中含有3个原子,所以其所含原子的总数为0.5mol×3×NA=9.03×1023。(2)Cl-的物质的量为0.200mol,所以MCl2的物质的量为0.100mol,根据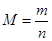 ,M=9.5g÷0.1mol=95g/mol;金属M的相对原子质量为95—35.5×2=24
,M=9.5g÷0.1mol=95g/mol;金属M的相对原子质量为95—35.5×2=24
考点:本题考查摩尔质量、气体摩尔体积。
本题难度:一般
2、选择题 用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.28g氮气所含有的原子数目为NA
B.1mol铁与足量稀盐酸反应转移的电子数目为3NA
C.标准状况下,22.4L水中含有的水分子数目为NA
D.10g重水(2H216O)中含有的中子数目为5NA
参考答案:D
本题解析:
试题分析:A、28g氮气的物质的量=28g÷28g/mol=1mol,氮气是双原子分子,因此28g氮气所含有的原子数目为2NA,A不正确;B、铁与盐酸反应生成氯化亚铁和氢气,因此1mol铁与足量稀盐酸反应转移的电子数目为2NA,B不正确;C、标准状况下水不是气态,不能适用于气体摩尔体积,所以标准状况下,22.4L水中含有的水分子数目不是NA,C不正确;D、重水中含有的中子数是(2-1)×2+16-8=10个,10g重水(2H216O)的物质的量=10g÷20g/mol=0.5mol,因此分子中含有
本题难度:一般
3、选择题 露置的苛性钾经分析,其中含有的各种物质的质量分数分别为:H2O 7.62%,K2CO3 2.38%,KOH 90%。若将此样品1 g加入到1 mol·L-1的盐酸46.00 mL中,过量的盐酸用1.070 mol·L-1 KOH溶液恰好中和。蒸发中和后的溶液,可得固体()
A.3.43 g
B.4.00 g
C.4.50 g
D.无法计算
参考答案:A
本题解析:最后溶液中的溶质为KCl,根据原子守恒,HCl~KCl,则m(KCl)="1" mol·L-1×0.046 L×74.5 g·mol-1="3.43" g。
本题难度:简单
4、选择题 下列说法中(NA代表阿伏加德罗常数的值),不正确的是
A.标准状况下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA
B.常温下,2.3g Na完全与O2反应失去的电子数为0.1NA
C.100mL 18.4mol·L-1的硫酸与足量铜反应,生成二氧化硫的分子数小于0.92 NA
D.在密闭容器中加入1.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA
参考答案:D
本题解析:
试题分析:A、CO和CO2中均含有1个碳原子,则标准状况下,2.24LCO和CO2混合气体即10.1mol混合气体中含有的碳原子数目为0.1NA,A正确;B、钠在反应中只能失去1个电子,则常温下,2.3g Na的物质的量是2.3g÷23g/mol=0.1mol,完全与O2反应失去的电子数为0.1NA,B正确;C、铜与浓硫酸的反应过程中硫酸的浓度逐渐降低,稀硫酸与铜不反应,因此100mL 18.4mol·L-1的硫酸与足量铜反应,生成二氧化硫的分子数小于0.92 NA,C正确;D、氨气的合成是可逆反应,则在密闭容器中加入1.5mol H2和0.5molN2,充分反应后可得到NH3分子数小于NA,D错误,答案选D。
考点:考查阿伏伽德罗常数的计算
本题难度:一般
5、选择题 下列说法错误的是(??? )
A.1 mol 任何物质都约含有6.02×1023个原子
B.0.012 kg12C中含有约6.02×1023个碳原子
C.阿伏加德罗常数的粒子集体就是1 mol
D.使用摩尔表示物质的量时必须指明粒子的名称
参考答案:A
本题解析:构成物质的粒子除原子外,还有分子、离子等,所以1 mol物质不是都含有6.02×1023个原子,若是1 mol铝或1 mol氦气,可以这样论。但若是1 mol双原子分子或多原子物质就不同,例如1 mol CaCl2含有1 mol?? Ca2+(即6.02×1023个Ca2+)和2 mol Cl-(即1.204×1024个Cl-),所以A不正确。0.012 kg12C中所含的碳原子数,即为阿伏加德罗常数,约为6.02×1023,故B选项正确。1 mol任何物质所含粒子数即为阿伏加德罗常数,所以阿伏加德罗常数
本题难度:简单