微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 2001年报道硼和镁形成的化合物刷新了金属化合物超导的最高纪录。下图示意的是该化合物的晶体结构:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱内。则该化合物的化学式为
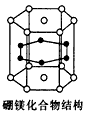 [???? ]
[???? ]
A. MgB
B. MgB2
C. Mg2B
D. Mg3B2
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列说法中错误的是( )
A.手性催化剂主要催化一种手性分子的合成
B.原子晶体的熔点一定比金属晶体的高
C.元素电负性越大的原子,吸引电子的能力越强
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
参考答案:B
本题解析:
试题分析:B项:钨的熔点(3410℃)比硅(1410℃)高,因此,原子晶体的熔点一定比金属晶体的高的说法也是错误的,故错。故选B。
点评:本题考查的是手性、原子晶体和金属晶体的相关知识,题目难度不大,注意对基础知识的学习、掌握及应用。
本题难度:一般
3、选择题 下列晶体分类中正确的一组是( )
?
| 离子晶体
| 原子晶体
| 分子晶体
|
A
| NaOH
| Ar
| SO2
|
B
| H2SO4
| 石墨
| S
|
C
| CH3COONa
| SiO2
| CO2
|
D
| Ba(OH)2
| 金刚石
| 玻璃
参考答案:C
本题解析:
试题分析:Ar是分子晶体,A不正确;硫酸是分子晶体,石墨是混合型晶体,B不正确;玻璃是混合物,不是晶体,答案选C。
点评:离子间通过离子键形成的晶体是离子晶体,分子间通过分子间作用力形成的晶体是分子晶体,原子间通过共价键形成的空间网状结构的晶体是原子晶体,由金属阳离子和自由电子构成的晶体是金属晶体,据此可以进行有关判断。
本题难度:一般
4、选择题 N—H键能的含义是( )?
A.由N和H形成1 mol NH3所放出的热量?
B.把1 mol NH3的键全部拆开所吸收的热量?
C.拆开6.02×1023个N—H键所吸收的能量?
D.形成1个N—H键所放出的热量
参考答案:C
本题解析:本题考查键能的定义,键能是气态基态原子形成1 mol化学键释放的最低能量或断开l mol该键成为气态基态原子所吸收的最低能量。?
本题难度:一般
5、选择题 根据下表给出的几种物质的熔点、沸点数据判断说法中错误的是

A.SiCl4是分子晶体
B.MgCl2中键的强度比NaCl中键的强度小
C.单质R是原子晶体
D.AlCl3为离子晶体
参考答案:D
本题解析:
试题分析:根据表格中氯化物的熔沸点判断物质的晶体类型,一般离子晶体的熔沸点大于分子晶体的熔沸点。
A.由表格中的数据可知SiCl4的熔沸点较低,则SiCl4是分子晶体,故对;
B.由表格中的数据可知,NaCl的熔点高,则MgCl2比NaCl更容易熔化,MgCl2中键的强度比NaCl中键的强度小,故对.
C.由表格中的数据可知,单质B的熔沸点很高,则可能为原子晶体,故对;
D.由表格中的数据可知,AlCl3的熔点比沸点较低,所以在加热时能升华,应为分子晶体,故错;
故选
本题难度:一般
|