微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 事实上,很多非金属氧化物在一定条件下都能与Na2O2反应,且反应极有规律.如:Na2O2+SO2═Na2SO4,2Na2O2+2SO3═2Na2SO4+O2.据此,你认为下列反应方程式中正确的是
①2Na2O2+2Mn2O7═4NaMnO4+O2↑?????????????
②Na2O2+2NO2═2NaNO2+O2
③2Na2O2+2N2O3═4NaNO2+O2
④2Na2O2+2N2O4═4NaNO3.
A.①②
B.②③
C.③④
D.①④
参考答案:D
本题解析:分析:依据所给的例子可以知道:当过氧化钠与最高价态的氧化物反应生成该元素的最高价态的含氧酸盐和氧气,如果是和较低价态的氧化物反应生成该元素的最高价态的含氧酸盐.
解答:当过氧化钠与最高价态的氧化物反应生成该元素的最高价态的含氧酸盐和氧气,如果是和较低价态的氧化物反应生成该元素的最高价态的含氧酸盐.
①七氧化二锰是最高价态的锰的氧化物,但NaMnO4中的锰为+7价,符合上述规律,故①正确;
②二氧化氮是低价态的氮的氧化物,NaNO2中氮元素化合价是+3价,不是最高价,不符合上述规律,故②错误;
③三氧化二氮是低价态的氮的氧化物,NaNO2中氮元素化合价是+3价,不是最高价,不符合上述规律,故③错误;
④四氧化二氮不是最高价态的氮的氧化物,因此过氧化钠与四氧化二氮反应生成硝酸钠,故④正确;
故选D.
点评:本题根据题目信息得出规律,主要考查化学方程式的书写,难度较大.
本题难度:简单
2、选择题 向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入400 mL0.5 mol·L-1的盐酸,恰好使混合物溶解,并放出标准状况下的气体224 mL,所得溶液中加入KSCN溶液无血红色出现,若用足量的CO在高温下还原质量相同的此混合物,得到铁的质量为
A.11.2 g
B.22.4 g
C.5.6 g
D.无法计算
参考答案:C
本题解析:混合物溶解后所得溶液中加入KSCN无血红色出现,说明溶液为FeCl2溶液,根据Cl-守恒可知n(Fe2+)=0.1 mol,根据Fe元素守恒,最后得到Fe的物质的量为0.1 mol,即5.6 g.
本题难度:一般
3、选择题 镁、铝、铜组成的混合物10.3克,在空气中充分加热至恒重,质量变为13.5克.如果将所得固体溶解,需要消耗6mol?L-1的硫酸
A.0.1mol
B.0.2mol
C.50mL
D.60mL
参考答案:B
本题解析:分析:镁、铝、铜组成的混合物在空气中充分加热至恒重,生成金属氧化物,固体增加的质量3.2g是氧元素的质量,金属氧化物与硫酸反应生成硫酸盐与水,水中氧原子来源于金属氧化物,水中氢原子来源于硫酸,利用氧原子计算生成的水的物质的量,根据水计算参加反应的硫酸的物质的量,据此计算消耗硫酸溶液体积.
解答:镁、铝、铜组成的混合物在空气中充分加热至恒重,生成金属氧化物,固体增加的质量13.5g-10.3g=3.2g是氧元素的质量,所以氧原子的物质的量为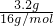 =0.2mol.
=0.2mol.
金属氧化物与硫酸反应生成硫酸盐与水,水中氧原子来源于金属氧化物,根据氧原子守恒,生成水的物质的量为0.2mol.
水中氢原子来源于硫酸,根据氢原子守恒可知,参加反应硫酸的物质的量为0.2mol.
所以需要消耗6mol?L-1的硫酸的体积为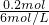 =0.033L=33ml.
=0.033L=33ml.
故选:B.
点评:考查混合物的有关计算,难度中等,关键判断固体增加的质量是氧元素的质量及根据守恒计算,用常规方法无法计算.是对学生综合能力的考查.
本题难度:困难
4、选择题 下列各组溶液中,将甲溶液逐滴加入乙溶液中与将乙溶液逐滴加入甲溶液中现象完全相同的是
A.A
B.B
C.C
D.D
参考答案:D
本题解析:分析:A、碳酸钠滴入盐酸中放出气体;盐酸滴入碳酸钠溶液中开始无气体最后有气体生成;
B、氯化铝溶液滴入氢氧化钠溶液中,开始无现象,继续滴入会出现白色沉淀;氢氧化钠溶液滴入氯化铝溶液中,出现白色沉淀,继续滴入白色沉淀溶解;
C、四羟基合铝酸钠溶液滴入盐酸中,无现象,继续滴入会产生沉淀;盐酸滴入四羟基合铝酸钠溶液中会出现白色沉淀,继续滴入沉淀溶解;
D、氢氧化钡溶液滴入硫酸中生成白色沉淀,;酸滴入氢氧化钡溶液中生成白色沉淀.
解答:A、碳酸钠滴入盐酸中放出气体,发生反应CO32-+2H+=CO2↑+H2O;盐酸滴入碳酸钠溶液中开始无气体最后有气体生成;发生的反应CO32-+H+=HCO3-?? HCO3-+H+=CO2↑+H2O,故A不选;
B、氯化铝溶液滴入氢氧化钠溶液中,无现象,发生的反应是Al3++4OH-=-=[Al(OH)4]-;继续滴入会出现白色沉淀,Al3++3[Al(OH)4]-=4Al(OH)3↓;氢氧化钠溶液滴入氯化铝溶液中,出现白色沉淀,Al3++3OH-=Al(OH)3↓,继续滴入白色沉淀溶解,Al(OH)3+OH-=[Al(OH)4]-,故B不选;
C、四羟基合铝酸钠溶液滴入盐酸中,无现象,发生的反应Al(OH)4-+4H+=Al3++4H2O;继续滴入会产生沉淀,Al3++3Al(OH)4-=4Al(OH)3↓;盐酸滴入四羟基合铝酸钠溶液中会出现白色沉淀,Al(OH)4-+H+=Al(OH)3↓+H2O;继续滴入沉淀溶解,Al(OH)3+3H+=Al3++3H2O,故C不选;
D、氢氧化钡溶液滴入硫酸中生成白色沉淀;硫酸滴入氢氧化钡溶液中生成白色沉淀,反应都是Ba2++SO42-=BaSO4↓,故D选;
故选D.
点评:本题考查了几组物质的化学性质的应用,主要考查正滴入和反滴入的现象分析判断和现象判断.
本题难度:一般
5、选择题 CO和H2是有机合成的重要原料.某化学小组拟用下列装置制取合成气CO、H2.将xmol?O2和一定量CH4在燃烧室中不完全燃烧,产生的物质完全进入催化室与CH4恰好完全反应,生成CO和H2.则从催化室中出来的H2为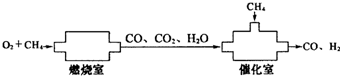
A.xmol
B.3xmol
C.4xmol
D.5xmol
参考答案:C
本题解析:分析:反应的总方程式为:O2+2CH4=2CO+4H2,根据方程式计算.
解答:分析反应物和最终生成物,由质量守恒定律可得反应的总化学方程式为O2+2CH4=2CO+4H2,则
O2+2CH4=2CO+4H2
1??????????? 4
xmol???????? 4xmol
则n(H2)=4xmol,
故选C.
点评:本题考查化学方程式的有关计算,题目难度不大,本题注意分析反应物和最终生成物,写出反应的总化学方程式为解答该题的关键.
本题难度:困难