微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是
①标准状况下,1molSO2和1molSO3具有相同的体积;②SO2使溴水、高锰酸钾酸性溶液褪色是因为SO2有漂白性;③SO2有漂白性,湿润的氯气也有漂白性,若将SO2和Cl2以等物质的量混合后通入品红溶液中,一定褪色更快;④SO2溶于水,得到的溶液有氧化性,还有还原性;⑤SO2通入Ba(OH)2溶液中,有白色沉淀生成,加入稀硝酸最终沉淀将全部溶解⑥SO2通入BaCl2溶液中无沉淀生成。
A.①②
B.③⑤
C.④⑥
D.①③⑥
参考答案:C
本题解析:
试题分析:标准状况下,三氧化硫不是气体,不能适用于气体摩尔体积,①不正确;②不正确,是利用的SO2的还原性;③不正确,因为二者混合发生氧化还原反应生成盐酸和硫酸,失去漂泊性;⑤不正确,因为硝酸极易氧化性,能氧化亚硫酸钡生成硫酸钡,其余选项都是正确的,答案选C。
点评:该题可以通过排除法逐一筛选即可得出正确的答案。
本题难度:一般
2、填空题 亚硫酸钠中的+4价硫,既有氧化性,又有还原性。现有试剂:溴水、Na2S溶液、 Na2SO3溶液、稀硫酸、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有_____,看到的现象是___________________________________。
反应的离子方程式为:_______________________。
(2)要证明Na2SO3具有氧化性,应选用的试剂有_____,看到的现象是___________________________________。
反应的离子方程式为:_______________________。
参考答案:(1)溴水、Na2SO3溶液 溴水颜色逐渐褪去????
本题解析:要证明Na2SO3具有还原性,只能选择氧化剂溴水,且溴水会褪色;要证明Na2SO3具有氧化性,应选用还原剂Na2S溶液,并选择稀硫酸作为酸性介质。
本题难度:一般
3、选择题 下列有关浓硝酸与浓硫酸的叙述中,正确的是(????)
A.常温下都能用铝容器贮存
B.露置在空气中,容器内酸液的质量都增加
C.常温下都能与铜较快反应
D.露置在空气中,容器内酸液的质量都减少
参考答案: 本题解析:常温下,铝在浓硫酸和浓硝酸中会发生钝化,因此选项A正确;浓硝酸易挥发,所以露置在空气中溶液的质量减少,而浓硫酸具有吸水性,溶液的质量是增加的,选项B和D不正确;铜和浓硫酸反应需要加热,C不正确,答案选A。
本题解析:常温下,铝在浓硫酸和浓硝酸中会发生钝化,因此选项A正确;浓硝酸易挥发,所以露置在空气中溶液的质量减少,而浓硫酸具有吸水性,溶液的质量是增加的,选项B和D不正确;铜和浓硫酸反应需要加热,C不正确,答案选A。
本题难度:一般
4、选择题 下列实验能证明SO2存在的是(?)
①能使澄清的石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使湿润的品红试纸褪色 ④通入足量的NaOH溶液,再加BaCl2溶液有白色沉淀生成 ,该沉淀溶于稀盐酸 ⑤通入氯水能使氯水褪色,再滴加BaCl2溶液有白色沉淀生成
A.都不能证明
B.③④⑤能证明
C.③⑤能证明
D.只有⑤能证明
参考答案:D
本题解析:
试题分析:CO2也能使澄清的石灰水变混浊,①不能证明;能使湿润的蓝色石蕊试纸变红,只能说明该气体溶于水显酸性,不能证明SO2的存在;氯气也能使湿润的品红试纸褪色,③不能说明。④中CO2也是符合的,不能证明SO2的存在。SO2气体检验还原性,能被氯水氧化生成硫酸,硫酸和氯化钡反应生成白色沉淀硫酸钡,因此⑤可以证明,答案选D。2检验的有关判断
点评:该题是高考中的常见题型和考点,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有
本题难度:一般
5、实验题 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
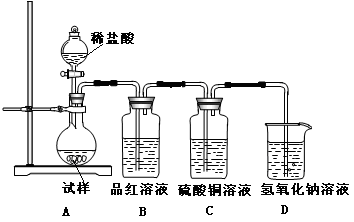
(1)若某种固体物质受热发生了分解,下列说法正确的是(?????)
A.充分加热后一定有固体残留?????????? B.加热前后固体颜色一定无变化
C.加热前后固体质量一定有变化???????? D.一定生成了新的物质
E.充分加热后得到的残留固体一定为混合物
(2)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体,则Na2SO3固体加热到600℃以上分解的化学方程式????????????????????????。如果加热温度低于600℃,向所得固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3—的物质的量浓度变化趋势为????????????????????????;
(3)如果加热温度高于600℃一段时间后,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则固体试样跟盐酸反应生成淡黄色沉淀的离子方程式为???????????????????????????????;此时在B、C两装置中可能观察到得现象为??????????????????????????????????????????????。
(4)在(3)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,以下是检验阴离子(X)的两种实验方案,你认为合理的方案是??????(填“甲”或“乙”),请说明另一方案不合理的原因 ?????????????????????????????。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
参考答案:(1)D(2分)
(2) 本题解析:
本题解析:
试题分析:(1)A.充分加热后不一定有固体残留,如碳酸氢铵分解,故A不符合;???B.加热前后固体颜色不一定无变化,如高锰酸钾溶液前后有元素变化,故B不符合;C.加热前后固体质量不一定有变化,如亚硫酸钠受热分解生成硫化钠和硫酸钠,因分解产物都是固体,因此反应前后固体质量并没有发生变化,故C不符合;????D.一定生成了新的物质,化学反应一定有新物质变化,故D符合;E.充分加热后得到的残留固体不一定为混合物,如氯酸钾完全分解生成氯化钾和氧气,故E不符合;故选D;?(2)由题意,Na2SO3要加热到6
本题难度:困难