?完全沉淀
?Fe(OH)3
?2.7
?3.7
?Al(OH)3
?3.7
?4.7
?Cr(OH)3
?4.7
?a
?Fe(OH)2
?7.6
?9.6
?Mg(OH)2
?9.6
?11.1
回答下列处理铬渣、消除铬污染的有关问题:
(1)将铬渣用稀硫酸浸取、过滤,在浸出液中加入适量的绿矾(FeSO4?7H2O),加入绿矾的目的是______.
(2)再向浸出液中缓慢加入烧碱,至pH刚好达到4.7,过滤,所得沉淀的化学式是______;常温下,Cr(OH)3的溶度积Ksp=10-32,要使Cr3+完全沉淀[c(Cr3+)降至10-5mol?L-1视为沉淀完全],溶液的pH应调于a=______.
(3)向(2)中得到的滤液中加入硫酸,调节至呈强酸性,所得的溶液是含______溶质的溶液.
参考答案:(1)根据污水中物质的含量可知,加入硫酸后,除SiO2不溶过
本题解析:
本题难度:一般
2、选择题 已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是(??)
A.Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
B.Cu2++H2S=CuS↓+2H+
C.Zn2++S2-+2H2O=Zn(OH)2↓+H2S↑
D.FeS+2H+=Fe2++H2S↑
参考答案:C
本题解析:因为MgCO3的溶解度大于Mg(OH)2的,所以会形成Mg(OH)2,A正确;H2S电离生成S2-的能力大于CuS的,小于FeS的,所以H2S与Cu2+反应生成更难电离的CuS,FeS与H+反应生成更难电离的H2S,B、D正确;依溶解度Zn(OH)2>ZnS,可知应该生成难溶的ZnS,C错误。
本题难度:简单
3、填空题 已知温度越高,AgI在水中的溶解度越大,现向有AgI固体的AgI饱和溶液中分别进行如下操作,有关离子浓度的变化情况是:
(1)若加入少量水,则c(I-)______(填“增大”、“减小”或“不变”)
(2)若加入AgNO3固体,则AgI在水中的溶解度______(填“增大”、“减小”或“不变”)
(3)若加入NaCl固体,则AgI的溶度积Ksp______(填“增大”、“减小”或“不变”)
(4)若某温度下,AgI的溶度积Ksp=9.0×10-20,则AgI在该温度下的溶解度是______g(AgI饱和溶液的密度可近似为1g?mL-1).
参考答案:在一定温度下,向AgI的饱和溶液中存在沉淀溶解平衡,AgI(
本题解析:
本题难度:简单
4、选择题 溶液中同时存在Mg2+、Fe2+、Mn2+和Al3+四种金属离子(浓度均为0.1mol/L)。现用碱调节溶液pH,根据右表可知,下列说法错误的是

A.Al3+最先转化为Al(OH)3沉淀
B.加碱过程中,Fe2+、Mn2+几乎同时转化为沉淀
C.要使Mg2+转化为沉淀,溶液pH应大于9
D.pH=14时,四种金属离子全部以沉淀形式存在
参考答案:D
本题解析:
试题分析:根据物质的溶度积常数可知,Mg2+、Fe2+、Mn2+和Al3+四种金属离开始沉淀时的OH-浓度值(mol/L)分别是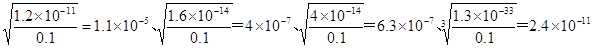 ,所以最先沉淀的是氢氧化铝,ABC正确;由于氢氧化铝是两性氢氧化物,所以当碱过量时,氢氧化铝溶解,选项D不正确,答案选D。 ,所以最先沉淀的是氢氧化铝,ABC正确;由于氢氧化铝是两性氢氧化物,所以当碱过量时,氢氧化铝溶解,选项D不正确,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试
本题难度:简单
5、选择题 下列有关Ksp说法正确的是
A.某温度下, CaSO4溶液中C(Ca2+) ·C(SO42-)就是 Ksp
B.25 ℃时, Fe(OH)3固体在0.01mol/LNH4Cl溶液中的溶解度增大,其Ksp也增大。
C.在一定条件下实现BaSO4+Na2CO3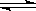 BaCO3+ Na2SO4,说明KSP(BaSO4)>KSP(BaCO3) BaCO3+ Na2SO4,说明KSP(BaSO4)>KSP(BaCO3)
D.升高温度,若某沉淀溶解平衡逆向移动, Ksp也变小
参考答案:D
本题解析:
正确答案:D
A.不正确,应是:某温度下,饱和 CaSO4溶液中C(Ca2+) ·C(SO42-)就是 Ksp
B. 不正确,应是:25 ℃时, Fe(OH)3固体在0.01mol/LNH4Cl溶液中的溶解度增大,其Ksp不变,Ksp只与温度有关。
C. 不正确,应是:在一定条件下实现BaSO4+Na2CO3 本题难度:一般 本题难度:一般
|