微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 某温度下22%NaNO3溶液150毫升,加100克水稀释后浓渡变成14%.求原溶液的摩尔浓度.
参考答案:设原溶液质量为m,则22%×m=14%×(m+100)g,解
本题解析:
本题难度:一般
2、简答题 向100mL?0.1mol/L的AlCl3溶液中滴加NaOH溶液,当滴加碱液800mL时,恰好完全反应得到澄清的溶液,求NaOH溶液的物质的量浓度.
参考答案:AlCl3的物质的量为0.1L×0.1mol/L=0.01m
本题解析:
本题难度:一般
3、选择题 下列说法错误的是
A.从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L
B.制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况)
C.0.5 L 2mol/L的氯化钡溶液中,钡离子和氯离子总物质的量为3mol
D.10g98%硫酸(密度为1.84g/cm3)与10mL18.4mol/L硫酸的浓度是不同的
参考答案:D
本题解析:
试题分析:98%的浓H2SO4的物资的量浓度为c="1000ρw" /98 =1000×1.84×98% /98mol/L=18.4mol/L与后者浓度相同,故D错误。
本题难度:一般
4、填空题 (15分)下图为实验室某浓盐酸试剂瓶上的标签,

试根据有关数据回答下列问题:
(1)该浓盐酸的物质的量浓度为_____mol·L—1。
(2)取用任意体积该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______。
A.溶液中Cl-的数目
B.溶液的密度
C.溶质的物质的量
D.溶液的浓度
(3)某学生欲用上述浓盐酸和蒸馏水配制450 mL物质的量浓度为0.4 mol/L的稀盐酸,该学生需要量取______mL上述浓盐酸进行配制(结果保留小数点后一位)。若用量筒量取浓盐酸时俯视观察凹液面,则所配制的稀盐酸物质的量浓度将 (填“偏高”、“偏低”或“无影响”,下同);若定容摇匀后发现液面低于刻度线,又补加水至刻度线,则所配制的稀盐酸物质的量浓度将 。
(4)取100mL 0.4 mol·L—1的盐酸与100mL 0.1 mol·L—1的AgNO3溶液混合,混合后的体积可近似为两溶液的体积之和,则所得溶液中Cl-的物质的量浓度为__ _ __。
参考答案:19.(15分,除标示外,每空2分) (1)11.8 (3分
本题解析:
试题分析:(1)浓盐酸的物质的量浓度为:C=1000pw%/M=1000x1.18x36.5%/36.5==11.8mol/L;
(2)A、n=CV,所以与溶液体积有关,A不符合.B、溶液的浓度是均一稳定的,与所取溶液的体积无关,B符合.C、N=nNA=CVNA,所以与溶液体积有关,C不符合.D、溶液的密度是均一的,所以与所取溶液的体积无关,D符合,选BD;
(3)用上述浓盐酸和蒸馏水配制450 mL物质的量浓度为0.4 mol/L的稀盐酸,根据稀释定律,0.5x0.4="11.8xV," 得到V=0.0168L=16.9mL;若用量筒量取浓盐酸时俯视观察凹液面,会使所以浓酸体积偏小,所配溶液浓度偏低;定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线,会导致加入的蒸馏水体积偏大,配制的溶液浓度偏低;
(4)Cl- + Ag+ =AgCl↓
0.04 0.01 剩余氯离子0.03mol 所以所得溶液中Cl-的物质的量浓度为0.03/0.2=0.15mol/L。
考点:考查溶液的配制及误差分析等知识。
本题难度:一般
5、填空题 天然碱的组成可以用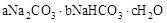 (a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
(a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
将质量为31.0 g的天然碱A于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2 2.24 L(标准状况)和水5.4 g。
(1)天然碱A的化学式中:
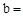
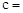
已知:Na2CO3与稀盐酸的反应分下列两步进行:
Na2CO3+HCl NaCl+NaHCO3?? NaHCO3+HCl
NaCl+NaHCO3?? NaHCO3+HCl NaCl+CO2↑+H2O
NaCl+CO2↑+H2O
将质量为12.45 g的天然碱B溶于水,逐滴滴加某浓度的稀盐酸,产生气体的体积与加入盐
酸的体积(标准状况)的关系如下表所示:
盐酸体积(mL)
| 20
| 40
| 60
| 80
|
产生气体体积(mL)
| 0
| 560
| 1680
| 2520
?
(2)由表中数据可推测加入50mL盐酸时,产生气体的体积为 mL(标准状况);盐酸的浓度为 mol/L;天然碱B的化学式为: ??????????????????? 。
(3)若取一定质量的天然碱B加入到30mL该浓度的盐酸中,请写出产生气体体积V(mL,标准状况)与天然碱B质量W(g) 之间的关系式。
参考答案:(1)a=1,b=2,c="2" (各1分,共3分)
本题解析:
试题分析:(1)利用2NaHCO3 Na2CO3+CO2↑+H2O 这个原理。由题意可知n(CO2)=0.1 mol。 Na2CO3+CO2↑+H2O 这个原理。由题意可知n(CO2)=0.1 mol。
2NaHCO3 本题难度:一般 本题难度:一般
|