微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究。
(1)[提出假设]向一定量的过氧化钠固体中通入足量的SO2,对反应后的固体产物成分及反应原理提出如下假设:
假设一:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设二:反应后固体中只有Na2SO4,证明SO2完全被氧化;?
假设三:反应后固体中____________?????????_____,证明???????????????????????。
(2)[定性研究]?
为验证假设三是否成立,兴趣小组进行如下研究,请你完成下表中内容
实验步骤(不要求写出具体操作过程)
| 预期的实验现象和结论
|
取反应后的固体放入试管中,……
| ?
?
(3)[定量研究]通过测量气体的体积判断发生的化学反应,实验装置如下:
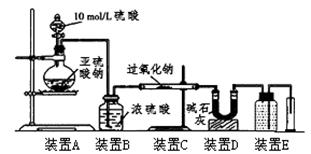
①装置D的作用是???????????????????。
②实验测得装置C中过氧化钠质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),用上述有关测量数据进行判断
SO2被氧化的程度
| V与m1或m2的关系
| 完全被氧化
| V=0
| 部分被氧化
| ????????????????????????
| 未被氧化
| ?????????????????????????
?
参考答案:(1)固体为Na2SO3和Na2SO4的混合物,证明二氧化硫
本题解析:
试题分析:(1)固体为Na2SO3和Na2SO4的混合物,证明二氧化硫部分被氧化;
(2)要证明假设3是否成立,就是要证明Na2SO3和Na2SO4存在,可以取反应后的固体放入试管中,加少量水溶解,加入BaCl2溶液,再加入稀盐酸。若加入BaCl2溶液有白色沉淀产生,加入盐酸沉淀部分溶解,则证明原固体中既有亚硫酸钠也有硫酸钠。
(3)①D的作用吸收未反应的SO2。
②若Na2SO3未被氧化发生的反应只有2Na2O2+2SO2=2Na2SO3+O2根据差量法得到V=7m1/3
本题难度:困难
2、选择题 关于SO2与NO2的下列说法错误的是
A.都能与氢氧化钠溶液反应
B.都能使石蕊试液变红
C.都能引起光化学烟雾的大气污染物
D.工业制硫酸、硝酸时要用到它们
参考答案:C
本题解析:引起光学化学烟雾的是氮氧化合物,二氧化硫引起酸雨。故答案为C。
本题难度:一般
3、选择题 下列关于SO2的说法,不正确的是
A.SO2能使品红溶液褪色
B.SO2能使紫色石蕊试液褪色
C.SO2能与水作用生成H2SO3
D.SO2是硫及其某些含硫化合物在空气中燃烧的产物
参考答案:B
本题解析:略
本题难度:一般
4、选择题 在氧气中灼烧0.44g由硫、铁元素组成的化合物,使其中的硫经过一系列变化最终全部转化为硫酸,用20mL0.5mol/L的烧碱溶液恰好能完全中和这些硫酸,则原混合物中硫的质量分数约为
A.36%
B.46%
C.53%
D.22%
参考答案:A
本题解析:依两摩尔氢氧化钠中和一摩尔硫酸,知硫酸的物质的量为0.005摩尔,据硫原子守恒知元化合物中硫原子也为0.005摩尔,其质量为0.005摩尔乘以32克每摩尔等于0.16克,易算出硫的质量分数约为36%
本题难度:一般
5、选择题 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是
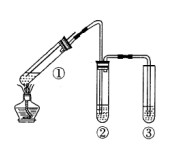
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
参考答案:D
本题解析:
试题分析:A、上下移动①中铜丝,当铜丝与浓硫酸接触就发生反应,当离开液面反应就停止。故可以控制SO2的量。正确。B、SO2有漂白性,能使品红溶液褪色。所以②中选用品红溶液验证SO2的生成。正确。C、SO2是酸性氧化物,能与碱发生反应。③中选用NaOH溶液吸收多余的SO2更环保、安全。正确。D、反应后装置中含有没反应的热的浓硫酸,所以为确认CuSO4生成,应把反应液冷却后加入到水中。即注酸入水。错误。
本题难度:一般
|
|