微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
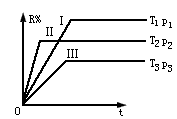
1、选择题 在一定的密闭容器中给定M、N、Q的物质的量,可逆反应mM(g)+nN(g) rR(g)+Q(g)中R的质量分数与时间t有如图所示的关系,以下说法不正确的是?
rR(g)+Q(g)中R的质量分数与时间t有如图所示的关系,以下说法不正确的是?
 [???? ]
[???? ]
A.I、Ⅱ、Ⅲ是三种不同的平衡状态
B.T2、p2条件下,该反应最先达到平衡
C.T1、p1条件下,该反应最先达到平衡
D.平衡状态I中,R的质量分数最大
参考答案:C
本题解析:
本题难度:一般
2、选择题 汽车尾气净化中的一个反应如下:NO(g)+CO(g) 1/2N2(g)+CO2(g) △H=-373.4kJ·mol-1。 在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是[???? ]
1/2N2(g)+CO2(g) △H=-373.4kJ·mol-1。 在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是[???? ]
A.
B.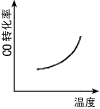
C.
D.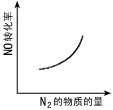
参考答案:C
本题解析:
本题难度:一般
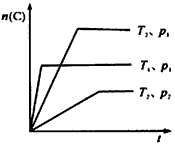
3、选择题 反应mA(g)+B(g)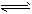 nC(g);△H=Q kJ/mol。在不同温度(T1和T2)及压强(p1和P2)下,产物C的物质的量n(C)与反应时间t的关系如图所示,下述判断正确的是
nC(g);△H=Q kJ/mol。在不同温度(T1和T2)及压强(p1和P2)下,产物C的物质的量n(C)与反应时间t的关系如图所示,下述判断正确的是
 [???? ]
[???? ]
A.Q>0
B.P1<P2
C.T1<T2
D.m≥n
参考答案:D
本题解析:
本题难度:一般
4、填空题 火力发电时排出的烟气中含有SO2,会造成一系列环境和生态问题。工业上利用的海水脱硫是一种有效的方法,工艺流程如图:
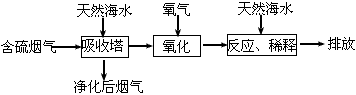
(1)天然海水呈碱性,请写出SO2与OH-反应的离子方程式:____。
(2)天然海水吸收含硫烟气后溶有H2SO3分子,用氧气将其氧化的化学方程式为:___。氧化后的“海水”需要引入大量天然海水与之混合后才排放的主要目的是____。
(3)为测定烟气中SO2的含量,将标准状况下500 mL的烟气通入20 mL 0.05 mol.L-1的高锰酸钾溶液,恰好使紫色刚好褪去:
①请配平方程式:___KMnO4+____SO2+____H2O==___MnSO4+____ K2SO4+___H2SO4
②所通烟气中SO2的体积百分含量为___。
(4)工业上常用可逆反应:2SO2+O2 2SO3 △H<0制备硫酸,下列对该反应的说法不正确的是____。
2SO3 △H<0制备硫酸,下列对该反应的说法不正确的是____。
A.当单位时间内消耗2 mol SO2的同时生成2 mol SO3,说明此时该反应达到平衡状态
B.升高温度,可以增大正、逆反应速率,平衡向右移动
C.温度不变,增大压强时,平衡向右移动
D.工业上通常在该反应中使用催化剂来提高SO2的转化率
参考答案:(1) SO2+2OH-=SO32- +H2O (或SO2+
本题解析:
本题难度:一般
5、填空题 化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
I.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极):
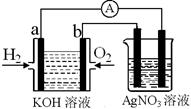
(1)对于氢氧燃料电池中,下列表达不正确的是________
A.a电极是负极,OH-移向正极
B.b电极的电极反应为:O2+2H2O+4e-=4OH-
C.电池总反应式为:2H2+O2 2H2O
2H2O
D.电解质溶液的pH保持不变
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100mL、0.1mol·L—1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=________(溶液体积变化忽略不计)
II.氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g) 2NH3(g)?? ΔH=-92.20 kJ·mol-1。
2NH3(g)?? ΔH=-92.20 kJ·mol-1。
(1)下列事实中,不能说明上述可逆反应已达到平衡的是________
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成n mol N—H的同时生成n mol N≡N
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1︰3︰2
④N2、H2、NH3的体积分数不再改变
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
时间(h)
物质的量(mol)
| 0
| 1
| 2
| 3
| 4
|
N2
| 1.50
| n1
| 1.20
| n3
| 1.00
|
H2
| 4.50
| 4.20
| 3.60
| n4
| 3.00
|
NH3
| 0
| 0.20
| n2
| 1.00
| 1.00
?
根据表中数据计算:
反应进行到2小时时放出的热量为________
0~1小时内N2的平均反应速率________mol·L-1·h-1;
③此条件下该反应的化学平衡常数K=________(保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向________?方向移动(填“正反应”或“逆反应”、“不移动”)。
参考答案:
I.(1)ACD (3分) (2)?? 1(2分)<
本题解析:
试题分析:I.中左边是燃料电池,右边是电解池,电解硝酸银溶液。(1)A、a电极是负极,OH-移向负极,错误;B、正确;C、反应条件不是燃烧,错误;D、反应生成水,使KOH浓度降低,pH减小,错误;E、正确;
(2)电子转移为0.112÷22.4×2=0.01mol,阳极反应为:4OH--4e-=O2↑+2H2O,
n(H+)=n(OH-)=n(e-)=0.01mol,c(H+)=0.001mol/L,pH=3;
II.(1)根据变量不变达平衡判断,反应速率判据两个方向,速率比为化
本题难度:困难
|