微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某校化学实验小组同学进行有关NO2气体的系列实验。
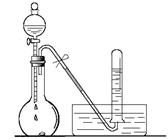
(1)如上图所示,烧瓶中放有少量铜片,打开分液漏斗的旋塞,加入过量浓硝酸,烧瓶中产生气体的颜色是???????,试管中收集的气体颜色是?????,用化学方程式表示其原因??????????????????????????;
(2)将烧瓶浸入冰水中,烧瓶内气体颜色?????(填“变深”、“不变”或“变浅”),使用化学用语和必要的文字说明颜色变化的原因?????????????????????????????????;
(3)在80℃时,将0.40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s)
| 0
| 20
| 40
| 60
| 80
| 100
|
n(N2O4)/mol
| 0.40
| a
| 0.20
| c
| d
| e
|
n(NO2)/mol
| 0.00
| 0.24
| b
| 0.52
| 0.60
| 0.60
①计算a = ??????,此温度时该反应的平衡常数K= ???????;
②平衡后,向该容器中再充入0.2molN2O4气体,则N2O4的转化率????????(填增大、减小或不变)
③改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有(填序号)?????。
A.增大N2O4的起始浓度?????????? B.升高温度
C.使用高效催化剂??????????????? D.向混合气体中通入稀有气体
参考答案:(11分)
(1)红棕色( 1分)无色( 1分)
本题解析:(1)烧瓶内发生的反应为:Cu + 4HNO3 (浓)===Cu(NO3)2 + 2NO2↑+ 2H2O,得到红棕色的气体NO2;
用排水法收集时发生反应:3NO2 + H2O===2HNO3 + NO,故在试管中收集到的气体为无色的NO
(2)由于存在可逆反应:2NO2 N2O4?ΔH<0,故将烧瓶浸入冰水中,相当于降温,平衡正向移动,c(NO2)浓度降低,混合气体的颜色变浅; N2O4?ΔH<0,故将烧瓶浸入冰水中,相当于降温,平衡正向移动,c(NO2)浓度降低,混合气体的颜色变浅;
(3)反应:N2O4 2NO2 2NO2
初n:????? 0.4?????? 0
20s:?????? 0.28????? 0.24
80s:?????? 0.1?????? 0.6
①可见a=0.28,在80s时反应达到平衡,K=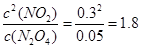
②平衡后,向该容器中再充入N2O4气体,相当于加压,平衡N2O4 2NO2左移,则N2O4的转化率减小 2NO2左移,则N2O4的转化率减小
③A.增大N2O4的起始浓度,相当于加压,平衡左移,c(NO2)/c(N2O4)值变小,符合题意
B.升高温度,平衡正向移动,排除
C.使用高效催化剂,不会影响平衡移动,排除
D.向混合气体中通入稀有气体,各物质浓度不变,平衡不移动,排除
选A
本题难度:一般
2、实验题 有人研究340K时N2O5的分解反应:2N2O5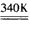 4NO2+O2,所得实验数据见下表。 4NO2+O2,所得实验数据见下表。
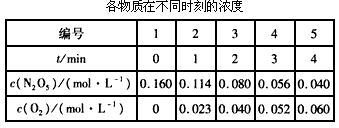
(1)图像能够非常直观地描述物理量的变化趋势。请在下图中作出N2O5与O2浓度随时间变化的关系图。
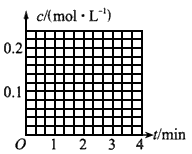
(2)数据处理是化学实验过程中非常重要的一个环节。请按下式计算化学反应速率,将计算结果填入表中。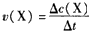
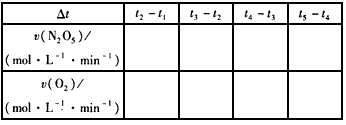
(3)根据计算结果寻找用各种物质表示的化学反应速率之间的关系__________________。
参考答案:(1)? ![]() 本题解析: 本题解析:
本题难度:一般
3、选择题 一定温度时于密封容器中发生反应:m A (g)+n B (g)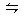 p C(g),达到平衡后,若将气体体积压缩到原来的一半,当再达平衡时C的溶液是原来的1.9倍,则下列叙述正确的是??????????????????????????????? (???? ) p C(g),达到平衡后,若将气体体积压缩到原来的一半,当再达平衡时C的溶液是原来的1.9倍,则下列叙述正确的是??????????????????????????????? (???? )
A.平衡向正反应方向移动
B.C气体的质量分数增大
C.气体A的转化率降低
D.m+n>p
参考答案:C
本题解析:将原平衡气体体积压缩到原来的一半,若平衡不移动,则此时C的溶液是原来的2倍,可现在却是原来的1.9倍,说明平衡向逆反应方向移动了。从而也说明m+n<p。
本题难度:一般
4、选择题 反应2SO2+O2 ?2SO3经一段时间后,SO3的浓度增加了0,4?mol/L,在这段时间内用O2表示的反应速率为0.04?mol/(L·s),则这段时间为[???? ] ?2SO3经一段时间后,SO3的浓度增加了0,4?mol/L,在这段时间内用O2表示的反应速率为0.04?mol/(L·s),则这段时间为[???? ]
A.0.1?s??
B.2.5?s
C.5?s??
D.10?s
参考答案:C
本题解析:
本题难度:一般
5、选择题 对平衡体系CO2 (g) CO2(aq)? ΔH=-19.75kJ·mol-,为了减小温室效应的产生,增大二氧化碳气体在水中的溶解度,应采取的方法是 CO2(aq)? ΔH=-19.75kJ·mol-,为了减小温室效应的产生,增大二氧化碳气体在水中的溶解度,应采取的方法是
A.升温增压
B.降温减压
C.升温减压
D.降温增压
参考答案:D
本题解析:
试题分析:减小温室效应的发生即是使二氧化碳气体尽可能多地进入溶液,使平衡向右移动,反应是放热反应且气体分子数减小的反应,所以应采取的措施是降温加压。
点评:勒沙特列原理在生产生活中的运用。
本题难度:一般
|