微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式中,正确的是?
A.氯化铁溶液中加入铜粉:Fe3++Cu ="=" Fe2++Cu2+
B.将含等物质的量的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-="=" BaCO3↓+H2O
C.少量SO2通入次氯酸钙溶液中:Ca2++2ClO- +SO2+H2O ="=" CaSO3↓+2HClO
D.少量AlCl3溶液滴入过量氨水中:Al3++4NH3?H2O="=" AlO2- +4NH4+ +2 H2O
参考答案:B
本题解析:考查离子方程式的正误判断。选项A不正确,电子得失不守恒;选项C不正确次氯酸钙具有氧化性,能把SO2氧化生成硫酸钙;氢氧化铝不能溶液弱碱氨水中,选项D不正确,因此正确的答案选B。
本题难度:一般
2、选择题 向等物质的量浓度的NaHCO3和Ca(HCO3)2的混合溶液中,加入一定量NaOH溶液时,不可能发生的离子反应方程式是???????? ( )。
A.OH-+HCO3—=CO32—+H2O
B.Ca2++OH-+HCO3—=CaCO3↓+H2O
C.Ca2++2OH-+2HCO3—=CaCO3↓+2H2O+CO32—
D.Ca2++3OH-+3HCO3—=CaCO3↓+3H2O+2CO32—
参考答案:A
本题解析:因溶液中存在Ca2+,故不可能生成CO32—,而应生成CaCO3沉淀。
本题难度:一般
3、填空题 锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。

回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是______,正极发生的主要反应是________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是_______。
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
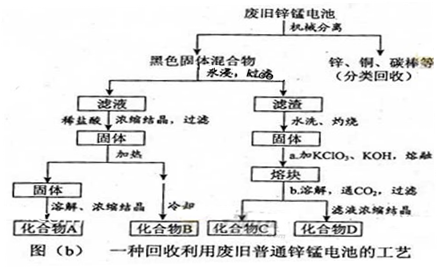
①图(b)中产物的化学式分别为A_______,B________。
②操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为_______。
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是?????????。(填化学式)
参考答案:(1)①Zn??? NH4Cl?? MnO2+NH4++e-
本题解析:(1)根据化学方程式Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH,锌是负极材料,氯化铵是电解质的主要成分,二氧化锰和铵根离子在正极发生反应,MnO2+NH4++e-="MnOOH+" NH3。与普通锌锰电池相比,碱性锌锰电池的优点及其理由是碱性电池不易发生电解质的泄露,因为消耗的负极改装在电池的内部,碱性电池的使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高。
(2)废电池经机械分离后,加水溶解后再加稀盐酸,浓缩结晶得到氯化铵和氯化锌。氯化铵不稳定,受热易
本题难度:一般
4、选择题 下表中评价合理的是( )
| 选项 | ?化学反应及离子方程式 | ?评价
?A
?氧化亚铁溶于稀硝酸FeO+2H+═Fe2++2H2O
?碱性氧化物与酸反应生成盐和水,正确
?B
?向亚硫酸铵溶液中加入少量氢氧化钡溶液
Ba2++SO32-═BaSO3↓
?复分解反应,有沉淀生成,正确
?C
?含nmolFeBr2的溶液中通入nmolCl2完全反应2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-
?氧化还原反应离子方程式满足元素守恒,电子守恒,电荷守恒,正确
?D
?三氯化铁溶液滴入硫氰化钾溶液:
Fe3++3SCN-═Fe(SCN)3
?复分解反应,无气体生成,无沉淀生成,不正确
A.A
B.B
C.C
D.D
参考答案:A、氧化亚铁溶于稀硝酸亚铁离子被硝酸氧化为三价铁,故离子方程
本题解析:
本题难度:简单
5、选择题 下列离子方程式正确的是( )
A.碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.氯化铵与氢氧化钠两种浓溶液混合加热:NH4++OH- ??△??
.
?
H2O+NH3↑
C.金属Na投入到CuSO4溶液中:2Na+Cu2+=2Na++Cu
D.次氯酸钙溶液中通入少量SO2气体:Ca2++ClO-+SO2+H2O=CaSO4↓+HCl
参考答案:A.碳酸氢钠溶液与少量石灰水反应的离子反应为2HCO3-+C
本题解析:
本题难度:简单
|
|
网站客服QQ: 960335752 - 14613519 - 791315772