微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 家用炒菜铁锅用水清洗后,放置一会出现红棕色的铁锈,在此变化过程中不会发生的化学变化是( )
A.2Fe+O2+2H2O=2Fe(OH)2
B.4Fe(OH)2+O2+2H2O=4Fe(OH)3
C.O2+2H2O+4e-=4OH-
D.Fe=Fe3++3e-
参考答案:A.铁、碳和电解质溶液构成了原电池,负极上铁失电子生成亚铁离
本题解析:
本题难度:一般
2、选择题 下列拟采用的金属防腐措施,错误的是
A.给金属衣架或电线外面包上一层塑料层
B.给自行车钢圈镀上一层金属铬
C.在轮船的外表面焊上一些铜块
D.给铁栅栏表面涂上一层油漆?
参考答案:C
本题解析:
试题分析: A、给金属衣架或电线外面包上一层塑料层,可以使金属与空气和水隔离,房子腐蚀,错误;B、金属铬具有很高的耐腐蚀性,在空气中,即便是在赤热的状态下,氧化也很慢。不溶于水,镀在金属上可起保护作用,错误;C、起不到防腐蚀的作用,正确;D、隔绝空气和水,可以防腐蚀,错误。
本题难度:简单
3、填空题 按要求填空:
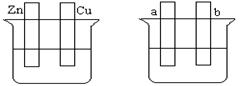
A??????????????????? B
(1)在A图中,稀硫酸为电解质溶液,用导线连接后,铜片电极反应式????????。
(2)在B图中外接直流电源,若要在a极镀铜,加以必要的连接后,该装置叫????????,b极电极反应式????????????????????????????????????。
(3)在B图中外接直流电源,若电极为惰性电极,电解质溶液是CuSO4溶液(足量),电解总反应离子方程式为????????????????????????,阴极增重3.2 g,则阳极上放出的气体在标准状况下的体积是_____L,加入一定量的?????后(填化学式),溶液能恢复至与电解前完全一致。
参考答案:(1)2H+ +2e=H2↑
(2)电镀池或电镀,Cu
本题解析:
试题分析:(1)A反应为锌铜原电池,锌被氧化成Zn2+进入溶液,电子由锌片通过导线流向铜片,溶液中的H+从铜片获得电子,被还原成氢原子。氢原子结合成氢分子从铜片上放出。两极发生如下反应:负极:Zn-2e-=Zn2+??正极: 2H+ +2e=H2↑??铜片上的反应为:2H+ +2e=H2↑
(2)电镀的条件为:电源、电极、电解质、闭合回路,,而且题中指出要在a极镀铜,所以此装置为电镀池。要在a极镀铜,那么a极发生的是还原反应,b极发生的是氧化反应,电极反应方程式为:Cu - 2e- = Cu
本题难度:一般
4、简答题 (12分)浸出-萃取-电积法已成为铜湿法冶金的主要工艺过程。以黄铜铜为原料,采用电积法生产阴极铜生产线,主要生产工艺为:
黄铜铜→硫酸浸出→过滤→萃取→反萃→电积→阴极铜。
(1)浸出是用浸矿剂将铜矿石中的铜进入溶液中。据报道,有一种叫Thibacillus Ferroxidans的细菌在氧气存在下,酸性溶液中,将黄铜矿氧化成硫酸盐,写出用硫酸浸出黄铜矿发生反应的离子方程式:???????????????????????????。
(2)萃取是利用特效铜萃取剂在含铜、铁及其碱性金属离子的低浓度含杂浸出液中有选择性地使铜离子萃入有机相,将铜离子与其它金属离子有效地分离,并通过反萃取使低浓度铜离子的原液富集成适宜电积要求的硫酸铜溶液。萃取过程的化学平衡为:2RH+Cu2+ R2Cu+2H+。则萃取和反萃取进行的程度受?????????和??????????的影响。
R2Cu+2H+。则萃取和反萃取进行的程度受?????????和??????????的影响。
(3)电积是将萃取富集后的铜溶液电解沉积出阴极铜。右图为用惰性阳极电积阴极铜的装置图:

①在图示方框中标出电源的正负极。
②写出电积阴极铜的总反应??????????????????????。
(4)金属铜长期露置于空气中容易生锈,铜锈的主要成分为?????,请利用电化学原理画出防止铜腐蚀的装置图。
参考答案:⑴4CuFeS2+4H++17O2=4Cu2++4Fe3++
本题解析:⑴根据提供信息,该反应为黄铜矿、氧气、硫酸发生氧化还原反应,生成硫酸铜、硫酸铁和水。
⑵根据萃取和反萃取的化学平衡,进行的程度受萃取液的pH和反萃取剂的酸度的影响。
⑶电解硫酸铜溶液的反应为2CuSO4+2H2O 2Cu+O2↑+2H2SO4,阳极产生氧气,与电源正极相连,阴极析出铜,与电源负极相连。
2Cu+O2↑+2H2SO4,阳极产生氧气,与电源正极相连,阴极析出铜,与电源负极相连。
本题难度:一般
5、选择题 为了防止轮船体的腐蚀,应在船壳水线以下位置嵌上一定数量的(??)
A.铜块
B.铅块
C.锌块
D.钠块
参考答案:C
本题解析:考查电化学的应用。金属的防护可以是牺牲阳极的阴极保护法或外加电流的阴极保护法。铜、铅的金属性都弱于铁。而钠又是活泼的金属,极易和水反应,锌的金属性强于铁,所以选项C正确,答案选C。
本题难度:简单