微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 二氧化硫的催化氧化原理为2SO2(g)+O2(g) 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
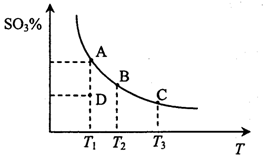
A.在D点时v E<v逆
B.反应2SO2(g)+O2(g) 2SO3(g)的△H<0
2SO3(g)的△H<0
C.若B、C点的平衡常数分别为KB、KC,则KB>KC
D.恒温恒压下向平衡体系中通入氦气,平衡向左移动
参考答案:A
本题解析:
试题分析:A、D点反应没有达到平衡状态,如果要达到平衡状态,则应保持温度不变,进行到A点即达到平衡,在反应过程中SO3的百分含量增加,这说明反应向正反应方向进行,因此正反应速率大于逆反应速率,A不正确;B、随着温度的升高,SO3的百分含量降低。这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应△H<0,B正确;C、C点温度高于B点温度,温度平衡向逆反应方向移动,平衡常数减小,所以B点平衡常数大于C点平衡常数,C正确;D、恒温恒压下向平衡体系中通入氦气,容器的容积增大,相当于是将原平衡体系降低压强,所以平衡向体积增大的逆反应方向,即向左移动,D正确,答案选A。
本题难度:一般
2、选择题 在10℃时某化学反应速率为0.1mol/(L·s),若温度每升高10℃反应速率增加到原来的2倍。为了把该反应速率提高到1.6 mol/(L·s),该反应需在什么温度下进行? [???? ]
A.30℃
B.40℃
C.50℃
D.60℃
参考答案:C
本题解析:
本题难度:简单
3、选择题 在一个体积可变的密闭容器中,通入2molHI气体,在一定条件下建立如下平衡:2H1(g) I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
A.保持容器体积不变,升高温度,混合气体的颜色逐渐变浅
B.保持容器体积与温度不变,充入一定量氦气(不参与反应),则正反应速率和逆反应速率均增大
C.保持温度不变,缓慢压缩容器,使容器体积恒定为0.2L,一定时间后,测得c(I2)=25mol/L
D.保持容器压强和温度不变,再通入2molHI气体,到达平衡状态后,测得HI的转化率为60%
参考答案:C
本题解析:略
本题难度:简单
4、实验题 (每空2分,共14分)在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
?
| 锌的质量/g
| 锌的形状
| 温度/℃
| 完全溶于水的时间/s
|
A
| 2
| 薄片
| 5
| 400
|
B
| 2
| 薄片
| 15
| 200
|
C
| 2
| 薄片
| 25
| 100
|
D
| 2
| 薄片
| 35
| t1
|
E
| 2
| 颗粒
| 15
| t2
|
F
| 2
| 粉末
| 15
| t3
|
G
| 2
| 薄片(含少量杂质Cu)
| 35
| t4
(1)t1=?????s,在答题卷的方框内画一幅以时间对温度的曲线图(纵轴表示时间,横轴表示温度)。
(2)利用所画的曲线图,关于温度影响反应速率的结论是????。
(3)t1????(填“>”或“<”)t4,原因是????。t2????t3(填“>”或“<”),原因是????。
参考答案:(每空2分,共14分)(1)? 50?, 本题解析:(1)根据表中ABCD数据可知,温度每升高10℃,反应速率加快到原来的2倍,所以t1=100s÷2=5s。 本题解析:(1)根据表中ABCD数据可知,温度每升高10℃,反应速率加快到原来的2倍,所以t1=100s÷2=5s。
(2)根据表中数据和图像可知,温度每升高10℃,反应速率加快到原来的2倍。
(3)实验G中含有杂质铜,所以能构成原电池,加快反应速率,因此时间少,即t1大于t4。又因为反应物的接触面积越大,反应速率越大,所以根据EF可知t2大于t3。
本题难度:一般
5、选择题 二氧化氮存在下列平衡:2NO2 N2O4(g);△H<0,在测定NO2的相对分子质量时,下列条件较为适宜的是 N2O4(g);△H<0,在测定NO2的相对分子质量时,下列条件较为适宜的是
A.温度130℃、压强3.03×105Pa
B.温度25℃、压强1.01×105Pa
C.温度0℃、压强5.05×104Pa
D.温度130℃、压强5.05×104Pa
参考答案:C
本题解析:要测NO2的相对分子质量,平衡要向逆反应方向移动,所以要求适当的低温和较高的压强,C正确。
本题难度:简单
|