微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 在工农业生产和日常生活中经常用到下列物质:①Si、②(NH4)2SO4、③Ca(ClO)2、④Al(OH)3、⑤Fe2O3.其中,可用于制造硅芯片的是______(填序号,下同);可用于杀菌、消毒的是______;可用作化肥的是______;可用作红色油漆和涂料的是______;医疗上可用作胃酸中和剂的是______.
参考答案:①Si原子最外层电子为4个,既难得电子,也难失去电子,可做为
本题解析:
本题难度:一般
2、选择题 新能源的开发利用是人类社会可持续发展的重要课题。下列属于新能源的是
A.氢气
B.煤炭
C.天然气
D.石油
参考答案:A
本题解析:
试题分析:根据能源的分类进行分析,煤、石油、天然气属于不可再生能源,而像太阳能、风能、核能、地热能、氢能等属于可再生能源,即新能源,故选A。
本题难度:一般
3、填空题 (1)为了提高生活用水的卫生标准,自来水厂常同时使用Cl2和FeSO4·7H2O进行消毒、净化,以改善水质,其原因是_____________________________。
(2)为了延长液氯杀菌时间,某些自来水厂在用液氯进行消毒处理时,还加入少量液氨,其反应的化学方程式为:NH3+HClO H2O+NH2Cl(一氯氨)。已知NH2Cl比HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是______________________________。
H2O+NH2Cl(一氯氨)。已知NH2Cl比HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是______________________________。
参考答案:(1)氯气杀菌、亚铁盐水解产生的胶体吸附悬浮杂质?
(
本题解析:(1)Cl2与FeSO4·7H2O同时使用可以改善水质的原因为:Cl2+H2O HCl +HClO,HClO具有强氧化性,能杀死水中的细菌,起消毒的作用。
HCl +HClO,HClO具有强氧化性,能杀死水中的细菌,起消毒的作用。
Cl2还可将Fe2+氧化成Fe3+:Cl2+2Fe2+====2Cl-+2Fe3+。Fe3+水解:Fe3++3H2O 本题难度:简单
本题难度:简单
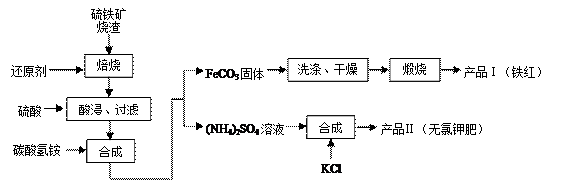
4、实验题 (12分)硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:
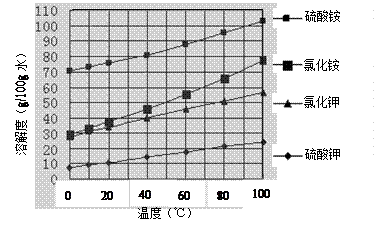
已知几种盐的溶解度随温度变化的曲线如右图所示:
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是________________。
(2)煅烧FeCO3生成产品I的化学反应方程式为________________________________。
实验室进行煅烧操作所需仪器除了酒精喷灯、泥三角、三脚架、玻璃棒外,还有__________。
(3)产品Ⅱ的化学式为_______________,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是:?????????????????????????????????????????????。
(4)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
5、填空题 (10分)硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%)。某同学设计了如下方案,分离样品中各种金属元素。请回答下列问题。

(1)写出溶液B的溶质是????????????。
(2)参照以下框的形式进一步完成“溶液C”到“Al2O3”的流程(注明试剂、条件和操作)。

(3)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成 Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①判断到达滴定终点的现象是????????????。
②某同学称取2.000g硫酸渣,预处理后在容量瓶中配制成100mL溶液,移到25.00mL试样溶液,用0.0050mol·L-1KMnO4标准溶液滴定,达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是???????????????。
参考答案:
 本题解析:略
本题解析:略
本题难度:一般